
【题目】天然气因含有少量H2S等气体开采应用受限,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A.该脱硫过程中Fe2(SO4)3可循环利用
B.由脱硫过程可知,氧化性强弱Fe2(SO4)3<S<O2
C.脱硫过程中O2间接氧化H2S
D.副产物硫单质可以用来制硫酸、化肥、火柴及杀虫剂等
【答案】B
【解析】
根据图像,反应I发生:Fe2(SO4)3+H2S=2FeSO4+S↓+H2SO4,反应II发生:4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O,据此分析;
A. 根据图像,反应I发生:Fe2(SO4)3+H2S=2FeSO4+S↓+H2SO4,反应II发生:4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O,因此硫酸铁在该脱硫过程中可循环使用,故A说法正确;
B. 反应I发生:Fe2(SO4)3+H2S=2FeSO4+S↓+H2SO4,硫酸铁作氧化剂,S为氧化产物,反应II发生:4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O,O2为氧化剂,硫酸铁为氧化产物,根据氧化剂的氧化性强于氧化产物的氧化性,因此有氧化性强弱:O2>Fe2(SO4)3>S,故B说法错误;
C. 根据A选项分析,O2间接氧化H2S,故C说法正确;
D. S单质通过燃烧生成SO2,SO2与O2反应生成SO3,因此可以利用副产物硫单质用来制造硫酸、化肥、火柴等,故D说法正确;
答案:B。


科目:高中化学 来源: 题型:
【题目】反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )

A、12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B、该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ
C、2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
D、该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》
(1)合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
①蛋白质是人体必需的营养物质,它在人体内最终分解为( )。
A.葡萄糖 B.氨基酸 C.脂肪酸
②现有下列五种物质 A食盐 B食醋 C苹果汁 D葡萄糖 E青霉素,请按下列要求填空(填序号)。
富含维生素C的是 ;可直接进入血液,补充能量的是 ;应用最广泛的抗生素之一的是 ;即可作为调味剂,又可作为防腐剂的是 ;食用过多会引起血压升高、肾脏受损的 。
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是( )。
A.酒精 B.蔗糖 C.甲醛
②一般情况下,合金比组成它的成分金属硬度 (填大、小)。
③常用来作半导体的物质是 (填化学式);用作食品保鲜膜的的高分子材料的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一有机化学基础](13分)
对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式 。
(2)PX 可发生的反应有 、 (填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A 是PX的一种同分异构体。

① B 的苯环上存在2 种不同化学环境的氢原子,则B 的结构简式是 。
② D 分子所含官能团是 (填名称)。
③ C 分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是
(4)F 是B 的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;b.遇FeCl3溶液显示特征颜色;c.能与碳酸氢钠溶液反应。
写出F 与NaHCO3溶液反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。用该废料制备纯度较高的氢氧化镍,工艺流程如图所示:
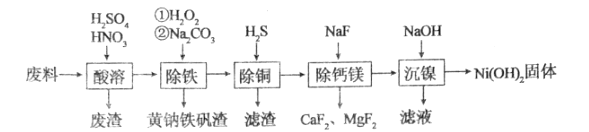
请回答下列问题:
(1)为了提高“酸溶”工序中原料的浸出效率,采取的措施不合理的有______。
A.搅拌
B.适当升高温度
C.研磨矿石
D.用浓硫酸
(2)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是______;合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成,金属镍溶解的离子方程式为______。
(3)“除铁”时控制温度不超过40℃的原因是______;加入碳酸钠的目的是______。
(4)Fe2+也可以用NaClO3氧化,生成的Fe3+在较小pH条件下水解,最终形成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀而被除去,图表示pH-温度关系,图中阴影部分为钠铁矾稳定存在的区域。
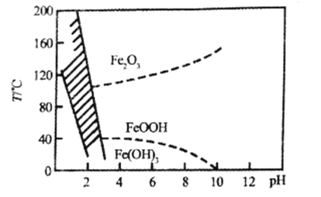
则下列说法不正确的是______(填字母)
a.黄钠铁矾[Na2Fe6(SO4)4(OH)12]中铁为+2价
b.pH过低或过高均不利于生成黄钠铁矾,其原因相同
c.氯酸钠在氧化Fe2+时,1 molNaClO3得到的电子数为6NA
d.工业生产中温度常保持在85℃-95℃,控制溶液的pH为1.2~1.8,此时加入Na2SO4后生成黄钠铁矾
(5)“除铜”时,反应的离子方程式为______,若用Na2S代替H2S除铜,优点是______。
(6)已知某温度下Ksp[Ni(OH)2]=4.0×10-15,该流程在“沉镍”过程中需调节溶液pH约为______,Ni2+才刚好沉淀完全(离子沉淀完全的浓度≤10-5mol/L;lg2=0.30)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了为锂离子电池发展作出重要贡献的科学家。高能 LiFePO4电池结构如图所示,电池中间为聚合物的隔膜,其主要作用是反应过程中只让Li+通过。已知电池的反应原理:(1-x)LiFePO4+xFePO4+LixCn ![]() LiFePO4+nC,下列说法正确的是
LiFePO4+nC,下列说法正确的是
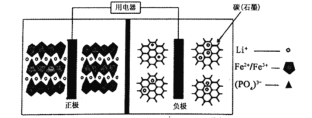
A.充电时,Li+向左移动
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC═LixCn
D.放电时,正极电极反应式:xLiFePO4-xe-═xFePO4+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量Na2CO3固体,c(OH-)增大,Kw不变,影响水的电离平衡
D.向纯水中加入盐酸,可抑制水的电离;加入醋酸,可促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界。试回答下列问题:
(1)砷的气态氢化物的电子式为___________,其稳定性比NH3_______(填“强”或“弱”)。
(2)NA表示阿伏加德罗常数的数值。46gNO2和N2O4的混合气体中含有____NA个氮原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol15N中,中子数比质子数多_______ NA个;1L 1mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式_________________________。
(4)砷的常见酸性氧化物有As2O3和As2O5,请根据图相关信息写出As2O5分解为As2O3的热化学方程式_______________________________________。

(5)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生活和生产中有着重要应用,科学使用含硫化合物对人体健康及环境保护意义重大。
(1)葡萄酒中添加微量的SO2可抑制细菌生长,防止葡萄酒被__(填“氧化”、“还原”)。
(2)氢的硫化物有多种:H2Sx(x=1,2,3,…),如H2S2,其结构与H2O2相似。请写出H2S3的结构式__。
(3)固体硫酸氢钾在加热熔化时,生成了焦硫酸钾(K2S2O7),反应中断裂的化学键类型为__。
(4)淮北某课题小组对连二亚硫酸钠(Na2S2O4)进行了如下探究。将0.050ml·L-1Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示(忽略溶液体积的变化)。
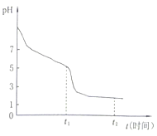
①Na2S2O4溶液显__性,原因是__(用离子方程式表示)。
②t1时溶液中只有一种溶质,此时含硫元素的粒子浓度由大到小的顺序为___。
0-t1段发生反应的离子方程式为__,t1-t2段溶液的pH变小的原因是__(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com