
【题目】氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界。试回答下列问题:
(1)砷的气态氢化物的电子式为___________,其稳定性比NH3_______(填“强”或“弱”)。
(2)NA表示阿伏加德罗常数的数值。46gNO2和N2O4的混合气体中含有____NA个氮原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol15N中,中子数比质子数多_______ NA个;1L 1mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式_________________________。
(4)砷的常见酸性氧化物有As2O3和As2O5,请根据图相关信息写出As2O5分解为As2O3的热化学方程式_______________________________________。

(5)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是________________________________。
【答案】![]() 弱 1 2 1 3 NaClO+2NH3=N2H4+NaCl+H2O As2O5(s) = As2O3(s) + O2(g) ; H= +295.4 kJ·mol-1 2NH3 + 6OH-—6e-=N2+6H2O
弱 1 2 1 3 NaClO+2NH3=N2H4+NaCl+H2O As2O5(s) = As2O3(s) + O2(g) ; H= +295.4 kJ·mol-1 2NH3 + 6OH-—6e-=N2+6H2O
【解析】
(1)砷与N同主族,根据元素周期律分析解答;
(2)根据n=![]() =
=![]() 结合分子的构成计算,Fe(NO3)3溶液中,c(NO3-)=3c[Fe(NO3)3],据此分析解答;
结合分子的构成计算,Fe(NO3)3溶液中,c(NO3-)=3c[Fe(NO3)3],据此分析解答;
(3)次氯酸钠与氨气反应,NaClO为氧化剂,NH3为还原剂,据此书写反应的方程式;
(4)由图象可知As2O3生成As2O5的反应热为(-914.6kJ/mol+619.2kJ/mol)=-295.4kJ/mol,以此可计算As2O5分解为As2O3的反应热;
(5)根据总反应,碱性条件下,氨气被氧化生成N2和水,据此分析书写电极反应式。
(1)砷的气态氢化物为AsH3,结构类似于氨气,电子式为![]() ,非金属性As<N,元素的非金属性越强,对应的氢化物越稳定,则稳定性比NH3弱,故答案为:
,非金属性As<N,元素的非金属性越强,对应的氢化物越稳定,则稳定性比NH3弱,故答案为:![]() ;弱;
;弱;
(2)NO2和N2O4的最简式都为NO2,则46gNO2和N2O4的混合气体中含有![]() =1molN原子,则N原子个数为NA;NO2和CO2的分子组成相似,则分子总数为NA个的NO2和CO2混合气体含2NA个氧原子数;15N中质子数为7,中子数为15-7=8,则1mol15N中,中子数比质子数多NA个,1mol/LFe(NO3)3溶液中,c(NO3-)=3mol/L,1L溶液中含有3molNO3-,即含3NA个NO3-离子,故答案为:1;2;1;3;
=1molN原子,则N原子个数为NA;NO2和CO2的分子组成相似,则分子总数为NA个的NO2和CO2混合气体含2NA个氧原子数;15N中质子数为7,中子数为15-7=8,则1mol15N中,中子数比质子数多NA个,1mol/LFe(NO3)3溶液中,c(NO3-)=3mol/L,1L溶液中含有3molNO3-,即含3NA个NO3-离子,故答案为:1;2;1;3;
(3)制备联氨可用丙酮为催化剂,以NaClO氧化NH3,反应中还原剂与氧化剂的物质的量之比为2∶1,反应的化学方程式为NaClO+2NH3═N2H4+H2O+NaCl,故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
(4)由图象可知As2O3生成As2O5的反应热为(-914.6kJ/mol+619.2kJ/mol)=-295.4kJ/mol,则As2O5分解为As2O3的反应热为+295.4kJ/mol,所以热化学方程式为As2O5(s)=As2O3(s)+O2(g) △H=+295.4 kJmol-1,故答案为:As2O5(s)=As2O3(s)+O2(g) △H=+295.4 kJmol-1;
(5)根据电池反应4NH3 + 3O2 = 2N2 + 6H2O可知,氨气被氧化,在负极发生氧化反应,碱性条件下,氨气被氧化生成N2和水,电极反应式为2NH3+6OH--6e-=N2+6H2O,故答案为:2NH3+6OH--6e-=N2+6H2O。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱的纯度。将2.5g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成250mL溶液。根据实验回答下列问题:
I.滴定前的准备
检漏→用蒸馏水清洗→用待装溶液润洗→装液→①→调节液而在“0”刻度或“0”刻度以下→记录初始读数
II.滴定
分别取20.00mL待测液于3个洁净的锥形瓶中,滴加2滴酚酞试液,然后用0.2000mol·L-1盐酸标准液进行滴定至终点,记录最终读数。数据如下:
滴定序号 | 待测液体积(mL) | 滴定前(mL) | 滴定后(mL) |
1 | 20.00 | 0.50 | 20.70 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 5.00 | 25.10 |
III.实验数据处理
(1)将步骤I中的操作补充完整:
①___________
(2)如图所示为___________ (填“酸式”或“碱式”)滴定管的一部分,若该滴定管漏水或转动不灵活,可采取的措施是___________
(3)滴定终点的现象是_______
(4)计算:NaOH溶液的浓度为_______mol·L-1烧碱样品的纯度为________
(5)试判断以下几种情况对烧碱纯度测定结果的影响(填“偏大”、“偏小”或“无影响”)
①若用蒸馏水冲洗锥形瓶,使测定结果_____________
②若滴定前滴定管尖嘴有气泡,滴定后气泡消失,使测定结果_____________
③若刚见到指示剂局部的颜色有变化就停止滴定,使测定结果_____________
④读数时,若滴定前仰视,滴定后俯视,使测定结果_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A.该脱硫过程中Fe2(SO4)3可循环利用
B.由脱硫过程可知,氧化性强弱Fe2(SO4)3<S<O2
C.脱硫过程中O2间接氧化H2S
D.副产物硫单质可以用来制硫酸、化肥、火柴及杀虫剂等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__。
(2)丙溶液中存在的电离平衡为__(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是__(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___。
(5)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示的两条滴定曲线,则a=__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:

(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
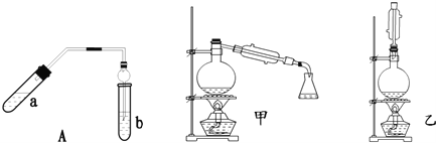
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
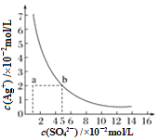
A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
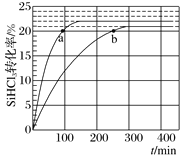
A.该反应的△H>0
B.a、b处反应速率大小关系:va大于vb
C.在343 K下,要提高SiHCl3转化率,可以及时移去产物或提高反应物浓度
D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温度下的平衡常数约为0.02
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com