
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究氰化物的性质:已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
25℃电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 Ki2=5.6×10﹣11 |
(1)NaCN溶液呈碱性的原因是________________________ (用离子方程式表示)
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是_________

A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN﹣+CO2+H2O=HCN+CO32﹣
C.图像中a点酸的总浓度小于b点酸的总浓度
D.c点溶液的导电性比a点溶液的导电性弱
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为_____。
(4)下列四种离子结合H+能力由弱到强的是______________________________________。
A. HCOO- B. CN- C. CO32- D.HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。

(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了延长水果的保鲜期,下列的水果存放方法最合适的是
A.放入敞口的容器中 B.放入浸泡过高锰酸钾溶液硅土的密封容器中
C.放入密封的容器中 D.放入充有少量乙烯的密封容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、铁及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价电子排布式为________,基态Fe原子未成对电子数为________个。
(2)团簇 中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
(3)工业上主要通过反应SO3+SCl2=SOCl2+SO2制备SOCl2(氯化亚砜),上述四种分子中,属于非极性分子的是________;SCl2分子空间构型为________形;SOCl2分子中心原子杂化方式是________。
(4)黄铁矿的晶体结构如图所示,已知黄铁矿晶胞参数为a=0.5417nm,阿伏加德罗常数的值为NA。则黄铁矿的密度为________g·cm-3(列出计算式)。
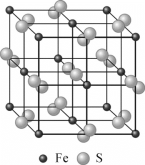
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是( )
A. 0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B. NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,如图1,请据图回答:

(1)小麦种子细胞中,物质A是______________,物质E是______________。艾滋病毒中的H彻底水解后可以得到________种产物。
(2)相同质量的E和F彻底氧化分解,耗氧量较多的是___________。
(3)若a个C物质组成b条链,组成某种物质G,该物质G至少含有氧原子的个数是________。若G是一条含121个氨基酸构成的链状结构,其中含5个甘氨酸(其R基为-H),分别位于26、71、72、99、121位(见下图)。
![]()
肽酶E1专门水解甘氨酸羧基端的肽键,肽酶E2专门水解甘氨酸氨基端的肽键。肽酶E1完全作用后产生的多肽中,至少有________个羧基。
(4)图二表示小麦开花数天后测定的种子中主要物质的变化图,请据图回答问题:
①小麦成熟种子中主要的有机营养物质是________,检测可溶性还原糖的试剂是_________,可溶性还原糖的多少可以通过________________来判断。
②种子成熟时,淀粉的形成与一种磷酸化酶的活性有密切关系,为了验证磷酸化酶是否为蛋白质,实验过程中实验组试管中加入2ml________,对照组试管中加入_______,然后在两支试管中分别加入等量双缩脲试剂,如果实验组试管中同样出现____________现象,则证明磷酸化酶是蛋白质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com