
【题目】下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
【答案】C
【解析】
A、AlCl3溶液中存在AlCl3+3H2O![]() Al(OH)3+3HCl,升高温度,促进水解,以及HCl的挥发,加热、蒸发、浓缩、结晶、灼烧,得到的物质是Al2O3,NaAlO2溶液中NaAlO2+2H2O
Al(OH)3+3HCl,升高温度,促进水解,以及HCl的挥发,加热、蒸发、浓缩、结晶、灼烧,得到的物质是Al2O3,NaAlO2溶液中NaAlO2+2H2O![]() NaOH+Al(OH)3,虽然加热促进水解,但NaOH是难挥发物质,最后得到物质仍为NaAlO2,所得固体成分不相同,故A错误;
NaOH+Al(OH)3,虽然加热促进水解,但NaOH是难挥发物质,最后得到物质仍为NaAlO2,所得固体成分不相同,故A错误;
B、FeCl3固体溶解在硫酸中,引入SO42-杂质,故B错误;
C、Fe3+发生水解反应:Fe3++3H2O![]() Fe(OH)3+3H+,加热促进水解,生成氢氧化铁沉淀,从而除去KCl溶液中混有的Fe3+,且与盐类水解有关,故C正确;
Fe(OH)3+3H+,加热促进水解,生成氢氧化铁沉淀,从而除去KCl溶液中混有的Fe3+,且与盐类水解有关,故C正确;
D、水垢成分是CaCO3,食醋的成分是CH3COOH,两者发生反应,生成醋酸钙和CO2,与盐类水解无关,故D错误。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图。

(1)丁子香酚分子式为 。
(2)下列物质在一定条件下能跟丁子香酚反应的是 。
a.NaOH溶液 b.NaHCO3溶液 c.FeCl3溶液 d.Br2的CCl4溶液
(3)符合下述条件的丁子香酚的同分异构体共有____________种,写出其中任意任一种结构简式___________。
① 与NaHCO3溶液反应
② 苯环上只有两个取代基
③ 苯环上的一氯取代物只有两种
(4)丁子香酚的某种同分异构体A可发生如下转化(部分反应条件已略去)。
提示:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO

A→B的化学方程式为_______________________,反应类型为______________________。C中滴加少量溴水振荡,主要现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、铝、镓、铟、铊是第ⅢA族元素,它们在工农业生产中应用非常广泛。
(1)基态硼原子的核外电子排布图为______________________。
(2)I1(Mg)___________I1(Al)(填“大于”或“小于”),其原因是______________________。
(3)三氯化铝加热到177.8℃时,会升华为气态二聚氯化铝(Al2Cl6,其中铝原子和氯原子均达8电子稳定结构),请写出二聚氯化铝(Al2Ci6)的结构式:______________________,其中铝原子轨道采用___________杂化。
(4)BF4-的空间构型为___________,与BF4-互为等电子体的分子是___________ (写化学式,任写一种即可)。
(5)镓(Ga)可与砷(As)形成砷化(GaAs)晶体,该晶体的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,阿伏加德罗常数值为NA,则晶胞中Ca与As原子的核间距为___________pm。(列出字母表达式)
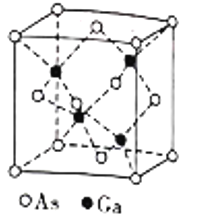
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在环保、化工行业有一种溶液浓度的表示方法:质量—体积浓度,用单位体积溶液中所含的溶质质量来表示,单位g·m-3或g·L-1。现有一种20 ℃时的饱和CuSO4溶液,密度为1.2 g·cm-3,质量—体积浓度为200 g·L-1,则对此溶液的说法不正确的是( )
A. 该溶液的质量分数为16.7%
B. 该溶液的物质的量浓度为1.25 mol·L-1
C. 在20 ℃时,硫酸铜的溶解度为20 g
D. 在20 ℃时把200 g CuSO4·5H2O溶解于1 L水中恰好得到饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定大量共存的是( )
A. 含有AlO2-的溶液中:Na+ 、Al3+、Cl-、K+
B. 常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中:Na+、NH![]() 、Cl-
、Cl-
C. 常温下 c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
D. 在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
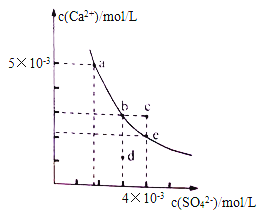
A. 曲线上任意一点的Ksp都相同
B. 在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由b点变化到c点
C. 蒸发水后,可使溶液由d点变化到b点
D. 常温下,CaSO4的Ksp的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)是应用广泛、性能较好的还原剂,以硼酸、甲醇和氢化钠(NaH)为原料可制得硼氢化钠。某学习小组的同学欲利用下图所示路线在实验室合成硼氢化钠。

I.氢化钠的制备
已知NaH的化学反应活性很高,在潮湿的空气中能自燃,与酸接触即放出热量和氢引发燃烧甚至爆炸。该小组的同学利用下图中的装置在实验室制取NaH。

(1)NaH中氢元素的化合价为___________,NaH的电子式为___________。
(2)按气流方向连接各仪器接口,顺序为a→___________b→c(填接口字母);连接装置后进行实验,在给装置B加热前,必须进行的一步操作是___________。
(3)装置A中盛装稀盐酸的仪器名称为___________,装置D中应盛装的试剂是___________。
(4)经分析,该实验装置有一个明显的不足是____________,解决此不足的措施是__________。
Ⅱ.硼氢化钠的制备与纯度测定
在搅拌加热到220℃时,向盛装NaH的缩合反应罐中加入硼酸三甲酯[B(OCH3)3],升温到260℃,充分反应后,经过处理得到NaBH4和甲醇钠。
(5)某同学欲通过测定硼氢化钠与水反应生成氢气的体积来测定硼氢化钠产品的纯度。
已知:NaH+H2O=H2↑+NaOH。
①硼氢化钠与水反应可以产生大量氢气和偏硼酸钠,该反应方程式为___________。
②该同学用图装置测定硼氢化钠产品的纯度(杂质只有氢化钠)。装置中a的作用是_________;称取6.28g氢化钠样品,重复实验操作三次,测得生成气体的平均体积为13.44L(已折算为标准状况),则样品中硼氢化钠的纯度为___________%(结果保留两位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
I3-(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )

A. 反应I2(aq)+I-(aq)![]() I3 -(aq)的ΔH>0
I3 -(aq)的ΔH>0
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入CCl4,平衡不移动
D. 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com