
【题目】下列溶液中有关物质的量浓度关系正确的是( )
A. 0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B. NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol/L
【答案】D
【解析】
根据共存因素对水解、电解程度的影响以及水解、电离过程的主次进行判断。
A项:0.1 mol/L的NaHA溶液中,有NaHA=Na++HA-。因pH=4,必有电离HA-![]() H++A2-,可能有水解HA-+H2O
H++A2-,可能有水解HA-+H2O![]() H2A+OH-,且HA-电离程度大于HA-水解程度。故c(A2-)>c(H2A),A项错误;
H2A+OH-,且HA-电离程度大于HA-水解程度。故c(A2-)>c(H2A),A项错误;
B项:NaHCO3溶液中,电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),物料守恒有c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)。两式相减得质子守恒c(H+) +c(H2CO3) =c(CO32-) +c(OH-)。B项错误;
C项:pH=1的CH3COOH溶液中有CH3COOH![]() CH3COO-+H+,pH=13的NaOH溶液中有NaOH=Na++OH-。两溶液等体积混合时,两者充分反应后,醋酸有大量剩余使溶液显酸性,得c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。C项错误;
CH3COO-+H+,pH=13的NaOH溶液中有NaOH=Na++OH-。两溶液等体积混合时,两者充分反应后,醋酸有大量剩余使溶液显酸性,得c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。C项错误;
D项:NaA溶液中,电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)。常温pH=8时,c(H+)=10-8mol/L,c(OH-)=10-6mol/L。故c(Na+)-c(A-)=c(OH-)-c(H+)=9.9×10-7 mol/L。D项正确。
本题选D。


科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)是应用广泛、性能较好的还原剂,以硼酸、甲醇和氢化钠(NaH)为原料可制得硼氢化钠。某学习小组的同学欲利用下图所示路线在实验室合成硼氢化钠。

I.氢化钠的制备
已知NaH的化学反应活性很高,在潮湿的空气中能自燃,与酸接触即放出热量和氢引发燃烧甚至爆炸。该小组的同学利用下图中的装置在实验室制取NaH。

(1)NaH中氢元素的化合价为___________,NaH的电子式为___________。
(2)按气流方向连接各仪器接口,顺序为a→___________b→c(填接口字母);连接装置后进行实验,在给装置B加热前,必须进行的一步操作是___________。
(3)装置A中盛装稀盐酸的仪器名称为___________,装置D中应盛装的试剂是___________。
(4)经分析,该实验装置有一个明显的不足是____________,解决此不足的措施是__________。
Ⅱ.硼氢化钠的制备与纯度测定
在搅拌加热到220℃时,向盛装NaH的缩合反应罐中加入硼酸三甲酯[B(OCH3)3],升温到260℃,充分反应后,经过处理得到NaBH4和甲醇钠。
(5)某同学欲通过测定硼氢化钠与水反应生成氢气的体积来测定硼氢化钠产品的纯度。
已知:NaH+H2O=H2↑+NaOH。
①硼氢化钠与水反应可以产生大量氢气和偏硼酸钠,该反应方程式为___________。
②该同学用图装置测定硼氢化钠产品的纯度(杂质只有氢化钠)。装置中a的作用是_________;称取6.28g氢化钠样品,重复实验操作三次,测得生成气体的平均体积为13.44L(已折算为标准状况),则样品中硼氢化钠的纯度为___________%(结果保留两位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Co3O4是一种电极材料,可用草酸盐湿式沉淀—煅烧分解法制备。
(1)先用(NH4)2C2O4溶液和CoCl2溶液为原料制取难溶于水的CoC2O4·2H2O晶体。
①已知25 ℃,Kb(NH3·H2O)=1.8×10-5,H2C2O4的Ka1=5.6×10-2,Ka2=5.4×10-5。(NH4)2C2O4溶液的pH__ (填“>”“=”或“<”)7。
②反应时,使(NH4)2C2O4过量的原因是________________________。
(2) 为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575 g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385 ℃以上残留固体均为金属氧化物)

①B处的物质为________(填化学式)。
②经测定,205~385 ℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积。(写出计算过程,结果保留2位有效数字) ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,反应原理为CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50 molCH4和1.2 mol NO2,测得n(CH4)(单位:mol)随时间变化的有关实验数据如表所示。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50 molCH4和1.2 mol NO2,测得n(CH4)(单位:mol)随时间变化的有关实验数据如表所示。
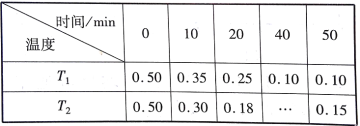
下列说法正确的是( )
A. T1温度下,0~20 min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T1<T2
C. 40min时,表格中T2应填的数据为0.18
D. 0~10 min内,CH4的降解速率T1> T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:2NO(g) + O2(g) ![]() 2NO2(g) △H= -113.0 kJ·mol-1,2SO2(g)+ O2 (g)
2NO2(g) △H= -113.0 kJ·mol-1,2SO2(g)+ O2 (g) ![]() 2SO3(g) △H=-196.6 kJ·mol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
2SO3(g) △H=-196.6 kJ·mol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为__________________________。
② 随温度升高,该反应化学平衡常数变化趋势是____________。(填“增大”或“减小”或“不变”)
(2)提高2SO2 + O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该温度下反应的平衡常数K=_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,升高体系温度
(3)汽车尾气是氮氧化物的一个主要来源。汽缸中生成NO的反应为:N2 (g) + O2 (g) ![]() 2NO(g) △H>0
2NO(g) △H>0
汽车启动后,汽缸温度越高,单位时间内NO的排放量越大,其原因是_______________。
(4)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式____________________。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
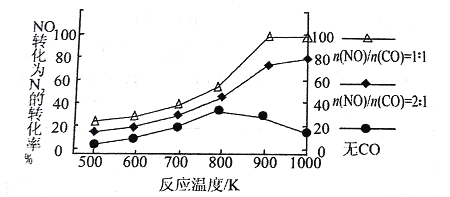
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别 为________、________;该反应的H________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 |
|
|
|
|
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A. 酸性强弱: ![]()
B. 离子的总浓度:①>③
C. ②中: ![]()
D. ②和④中![]() 相等
相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是组成细胞的主要元素及其比例,根据所示信息回答下列问题:

(1)构成细胞的主要元素有______________。
(2)组成生物体的最基本元素占细胞总量的______。
(3)在组成细胞的元素中,基本元素为____________,其在细胞鲜重情况下,百分比从多到少依次为______________;在细胞干重情况下,其占细胞干重百分比从多到少依次为_____________ 。
(4)组成细胞的元素大多以 _______ 的形式存在,一类是_________,另一类是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com