
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 |
|
|
|
|
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A. 酸性强弱: ![]()
B. 离子的总浓度:①>③
C. ②中: ![]()
D. ②和④中![]() 相等
相等
【答案】B
【解析】由表中数据得到,碱性:NaF<CH3COONa,所以说明阴离子的水解能力:F-<CH3COO-,根据越弱越水解的原理,得到酸性: ![]() 。选项A错误。①③两个溶液有各自的电荷守恒式:c(Na+) + c(H+) = c(Cl-) + c(OH-);c(Na+) + c(H+) = c(F-) + c(OH-),所以两个溶液的离子总浓度都等于各自的2[c(Na+) + c(H+)],因为两个溶液中的钠离子浓度相等,所以只需要比较两个溶液的氢离子浓度即可。pH为:①<③,所以①的氢离子浓度更大,即溶液①的2[c(Na+) + c(H+)]大于溶液③的2[c(Na+) + c(H+)],所以离子的总浓度:①>③,选项B正确。溶液②中,pH=7,所以c(H+) = c(OH-) = 1×10-7mol/L。明显溶液中的醋酸根和铵根离子的浓度都接近0.1mol/L(电离和水解的程度都不会太大),所以应该是
。选项A错误。①③两个溶液有各自的电荷守恒式:c(Na+) + c(H+) = c(Cl-) + c(OH-);c(Na+) + c(H+) = c(F-) + c(OH-),所以两个溶液的离子总浓度都等于各自的2[c(Na+) + c(H+)],因为两个溶液中的钠离子浓度相等,所以只需要比较两个溶液的氢离子浓度即可。pH为:①<③,所以①的氢离子浓度更大,即溶液①的2[c(Na+) + c(H+)]大于溶液③的2[c(Na+) + c(H+)],所以离子的总浓度:①>③,选项B正确。溶液②中,pH=7,所以c(H+) = c(OH-) = 1×10-7mol/L。明显溶液中的醋酸根和铵根离子的浓度都接近0.1mol/L(电离和水解的程度都不会太大),所以应该是![]() 。选项C错误。醋酸铵中,铵根离子对于醋酸根离子的水解起到促进作用,醋酸钠中钠离子对于醋酸根离子的水解应该无影响,所以醋酸根离子浓度是②<④,选项D错误。
。选项C错误。醋酸铵中,铵根离子对于醋酸根离子的水解起到促进作用,醋酸钠中钠离子对于醋酸根离子的水解应该无影响,所以醋酸根离子浓度是②<④,选项D错误。


科目:高中化学 来源: 题型:
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究氰化物的性质:已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
25℃电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 Ki2=5.6×10﹣11 |
(1)NaCN溶液呈碱性的原因是________________________ (用离子方程式表示)
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是_________

A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN﹣+CO2+H2O=HCN+CO32﹣
C.图像中a点酸的总浓度小于b点酸的总浓度
D.c点溶液的导电性比a点溶液的导电性弱
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为_____。
(4)下列四种离子结合H+能力由弱到强的是______________________________________。
A. HCOO- B. CN- C. CO32- D.HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是( )
A. 0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B. NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,如图1,请据图回答:

(1)小麦种子细胞中,物质A是______________,物质E是______________。艾滋病毒中的H彻底水解后可以得到________种产物。
(2)相同质量的E和F彻底氧化分解,耗氧量较多的是___________。
(3)若a个C物质组成b条链,组成某种物质G,该物质G至少含有氧原子的个数是________。若G是一条含121个氨基酸构成的链状结构,其中含5个甘氨酸(其R基为-H),分别位于26、71、72、99、121位(见下图)。
![]()
肽酶E1专门水解甘氨酸羧基端的肽键,肽酶E2专门水解甘氨酸氨基端的肽键。肽酶E1完全作用后产生的多肽中,至少有________个羧基。
(4)图二表示小麦开花数天后测定的种子中主要物质的变化图,请据图回答问题:
①小麦成熟种子中主要的有机营养物质是________,检测可溶性还原糖的试剂是_________,可溶性还原糖的多少可以通过________________来判断。
②种子成熟时,淀粉的形成与一种磷酸化酶的活性有密切关系,为了验证磷酸化酶是否为蛋白质,实验过程中实验组试管中加入2ml________,对照组试管中加入_______,然后在两支试管中分别加入等量双缩脲试剂,如果实验组试管中同样出现____________现象,则证明磷酸化酶是蛋白质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.6 g H2O的物质的量是____,含有水分子的数目是_____,含有氢原子的物质的量是_____。
(2)1.5molCO2和______g CH4在标准状况下占有相同的体积,其体积为________。
(3)在标准状况下,100mL某气体的质量为0.179g,该气体的相对分子质量为________。
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为______mol;一个X原子的质量为_______g;该气体在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
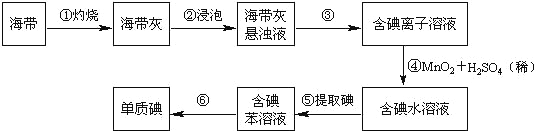
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据表中的信息回答下列问题
元素 | A | B | C | D | E |
有关信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 其原子M层有3个电子 | 食盐中的金属元素 | 单质在常温、常压下是黄绿色的气体 |
(1)D离子的结构示意图:________,B原子的电子式:________,E离子的电子式:________。
(2)和B元素的氢化物所含电子数相同的分子有多种,写出任意2种:________,________。
(3)A元素与E元素组成的化合物的电离方程式:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com