
【题目】对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
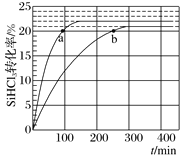
A.该反应的△H>0
B.a、b处反应速率大小关系:va大于vb
C.在343 K下,要提高SiHCl3转化率,可以及时移去产物或提高反应物浓度
D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温度下的平衡常数约为0.02
【答案】C
【解析】
温度越高反应越快,达到平衡用的时间就越少,所以曲线a代表343K的反应,曲线b代表323K的反应。
A、曲线a代表343K的反应,曲线b代表323K的反应,由图像可知,温度越高SiHCl3的平衡转化率越大,所以该反应的△H>0,故A正确;
B、a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即Va>Vb,故B正确;
C、 2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)只有一种反应物,增大反应物的浓度,相当于加压,反应前后气体系数和不变,加压平衡不移动,提高反应物浓度,SiHCl3的转化率不变,故C错误;
SiH2Cl2(g)+SiCl4(g)只有一种反应物,增大反应物的浓度,相当于加压,反应前后气体系数和不变,加压平衡不移动,提高反应物浓度,SiHCl3的转化率不变,故C错误;
D、设初始加入的三氯氢硅的浓度为1 mol·L-1,
2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)
SiH2Cl2(g)+SiCl4(g)
起始: 1 0 0
反应: 0.22 0.11 0.11(转化率为22%)
平衡: 0.78 0.11 0.11
所以平衡常数K=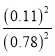 =0.02,故D正确;
=0.02,故D正确;
选C。


科目:高中化学 来源: 题型:
【题目】氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界。试回答下列问题:
(1)砷的气态氢化物的电子式为___________,其稳定性比NH3_______(填“强”或“弱”)。
(2)NA表示阿伏加德罗常数的数值。46gNO2和N2O4的混合气体中含有____NA个氮原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol15N中,中子数比质子数多_______ NA个;1L 1mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式_________________________。
(4)砷的常见酸性氧化物有As2O3和As2O5,请根据图相关信息写出As2O5分解为As2O3的热化学方程式_______________________________________。

(5)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生活和生产中有着重要应用,科学使用含硫化合物对人体健康及环境保护意义重大。
(1)葡萄酒中添加微量的SO2可抑制细菌生长,防止葡萄酒被__(填“氧化”、“还原”)。
(2)氢的硫化物有多种:H2Sx(x=1,2,3,…),如H2S2,其结构与H2O2相似。请写出H2S3的结构式__。
(3)固体硫酸氢钾在加热熔化时,生成了焦硫酸钾(K2S2O7),反应中断裂的化学键类型为__。
(4)淮北某课题小组对连二亚硫酸钠(Na2S2O4)进行了如下探究。将0.050ml·L-1Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示(忽略溶液体积的变化)。
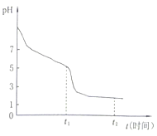
①Na2S2O4溶液显__性,原因是__(用离子方程式表示)。
②t1时溶液中只有一种溶质,此时含硫元素的粒子浓度由大到小的顺序为___。
0-t1段发生反应的离子方程式为__,t1-t2段溶液的pH变小的原因是__(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.室温下,氯化铵溶液pH<7的原因:NH4++H2O=NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
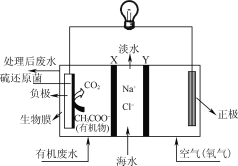
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,改变反应物的用量或者浓度不会改变反应产物的是
A.硫粉在空气中燃烧B.澄清石灰水和碳酸氢钠溶液反应
C.锌粉加入到![]() 溶液D.氯气通入
溶液D.氯气通入![]() 溶液中
溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基,I可以用E和H在一定条件下合成:
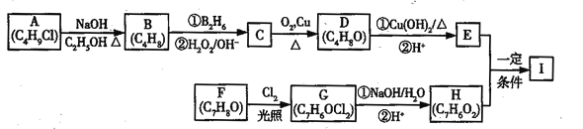
已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R﹣CH=CH2![]() R﹣CH2CH2OH;
R﹣CH2CH2OH;
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_______________________________;
(2)D的结构简式为_______________________________;
(3)E中的官能团名称为___________________________;
(4)F生成G的化学方程式为__________________________,该反应类型为______________;
(5)I的结构简式为_________________________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,共有____种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为:Li1﹣xCoO2+LixC6═LiCoO2+C6(x<1),下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6﹣xe﹣═xLi++C6
C.充电时,若转移1mole﹣,石墨(C6)电极将增重7xg
D.充电时,阳极的电极反应式为LiCoO2﹣xe﹣═Li1﹣xCoO2+xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com