
【题目】2019年诺贝尔化学奖颁给了为锂离子电池发展作出重要贡献的科学家。高能 LiFePO4电池结构如图所示,电池中间为聚合物的隔膜,其主要作用是反应过程中只让Li+通过。已知电池的反应原理:(1-x)LiFePO4+xFePO4+LixCn ![]() LiFePO4+nC,下列说法正确的是
LiFePO4+nC,下列说法正确的是
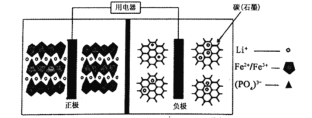
A.充电时,Li+向左移动
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC═LixCn
D.放电时,正极电极反应式:xLiFePO4-xe-═xFePO4+xLi+
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】己知:Mg(s)+2 H2O (g)=Mg(OH )2(s)+H2(g)△H1=﹣441kJmol﹣1
H2O(g)= ![]() H2(g)+O2(g)△H2=242kJmol﹣1
H2(g)+O2(g)△H2=242kJmol﹣1
Mg(s)+ ![]() O2(g)=MgO(s)△H3=﹣602kJmol﹣1
O2(g)=MgO(s)△H3=﹣602kJmol﹣1
①Mg(OH )2分解的热化学方程式为:________.
②Mg(OH )2可以作为阻燃剂的原因(写一条即可)________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的产量是衡量一个国家石油化工发展水平的标志,从A出发,可发生图示的一系列反应,G是一种油状有果香味的物质。请推断回答下列问题:

(1)A分子的核磁共振氢谱图中应有的组峰数为________
A.1 B.2 C.3 D.4
(2)反应②的反应类型为
A.取代反应 B.加成反应 C.消去反应 D.氧化反应
(3)①E和F所含官能团的名称分别为_____________和____________。
②化合物A的空间构型为________________。
③已知G的一种同分异构体具有C、E中的官能团,其结构简式为________________。
④写出反应③的化学方程式:______________________。
⑤E的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是一种重要的有机化工原料,如图所示是以有机物X为原料设计的合成路线(部分产物、个别合成路线、反应条件等略去)。
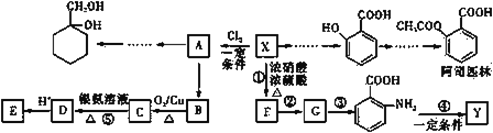
已知:i.X为芳香烃,其相对分子质量为92;Y是一种功能高分子材料。
ii.烷基苯在酸性高酸钾的作用下,侧链被氧化成羧基:
![]()
iii. (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X 结构简式为______。阿司匹林中官能团的名称为______。
(2)反应③的反应类型是______;反应②和③的顺序不能交换的原因是______。
(3)Y 的结构简式为______。
(4)已知 A 为一氯代物。反应⑤的离子方程式为______。
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有______种。
①芳香族化合物;
②不能发生水解反应,也不能发生银镜反应;
③1mol该有机物最多能与 2 mol NaHCO3完全反应。
(6)写出以 A 为原料制备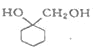 的合成路线流程图(其它试剂任选)_________________。
的合成路线流程图(其它试剂任选)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A.该脱硫过程中Fe2(SO4)3可循环利用
B.由脱硫过程可知,氧化性强弱Fe2(SO4)3<S<O2
C.脱硫过程中O2间接氧化H2S
D.副产物硫单质可以用来制硫酸、化肥、火柴及杀虫剂等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
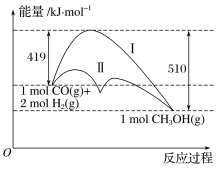
A.该反应的ΔH=+91kJ·mol-1
B.反应物的总键能小于生成物的总键能
C.加入催化剂,可以减小正反应的活化能,增大逆反应的活化能
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
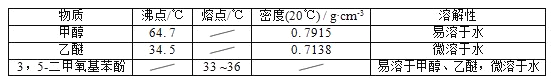
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com