
【题目】有机物X是一种重要的有机化工原料,如图所示是以有机物X为原料设计的合成路线(部分产物、个别合成路线、反应条件等略去)。
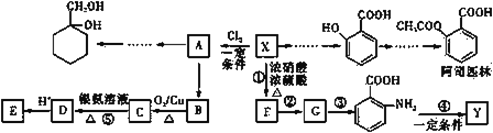
已知:i.X为芳香烃,其相对分子质量为92;Y是一种功能高分子材料。
ii.烷基苯在酸性高酸钾的作用下,侧链被氧化成羧基:
![]()
iii. (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X 结构简式为______。阿司匹林中官能团的名称为______。
(2)反应③的反应类型是______;反应②和③的顺序不能交换的原因是______。
(3)Y 的结构简式为______。
(4)已知 A 为一氯代物。反应⑤的离子方程式为______。
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有______种。
①芳香族化合物;
②不能发生水解反应,也不能发生银镜反应;
③1mol该有机物最多能与 2 mol NaHCO3完全反应。
(6)写出以 A 为原料制备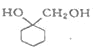 的合成路线流程图(其它试剂任选)_________________。
的合成路线流程图(其它试剂任选)_________________。
【答案】![]() 羧基、酯基 还原反应 避免氨基被酸性高锰酸钾氧化
羧基、酯基 还原反应 避免氨基被酸性高锰酸钾氧化 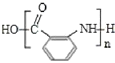
![]() +2Ag(NH3)2++2OH-
+2Ag(NH3)2++2OH-![]()
![]() +NH4++H2O+2Ag↓+3NH3 10
+NH4++H2O+2Ag↓+3NH3 10 
【解析】
X为芳香烃,其相对分子质量为92,可知X的分子式为C7H8,为甲苯(![]() )。
)。![]() 和氯气反应生成A,A反应生成B,B能被氧气在铜催化下氧化,说明B是醇,所以A为
和氯气反应生成A,A反应生成B,B能被氧气在铜催化下氧化,说明B是醇,所以A为 ,A发生水解反应生成B,则B为苯甲醇(
,A发生水解反应生成B,则B为苯甲醇( ),B催化氧化生成C,所以C是苯甲醛,苯甲醛发生银镜反应生成D,D再酸化得到E为苯甲酸。甲苯在浓硫酸作用下发生硝化反应生成F,F生成G,G生成
),B催化氧化生成C,所以C是苯甲醛,苯甲醛发生银镜反应生成D,D再酸化得到E为苯甲酸。甲苯在浓硫酸作用下发生硝化反应生成F,F生成G,G生成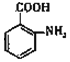 ,则F为甲苯苯环上和甲基处于邻位的氢原子被硝基取代生成,即F为
,则F为甲苯苯环上和甲基处于邻位的氢原子被硝基取代生成,即F为 ,Y是一种功能高分子材料,则是
,Y是一种功能高分子材料,则是 发生缩聚反应生成的高聚物。
发生缩聚反应生成的高聚物。
(1)由以上分析可知,X为甲苯,结构简式为![]() 。阿司匹林
。阿司匹林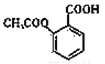 中官能团的名称为酯基、羧基;
中官能团的名称为酯基、羧基;
(2)F为 ,经两步反应生成
,经两步反应生成 ,甲基被高锰酸钾溶液氧化为羧基,硝基被还原为氨基,由于氨基易被氧化,所以要先把甲基氧化为羧基,然后再还原硝基为氨基,否则氨基会被高锰酸钾溶液氧化,故反应③的反应类型是还原反应;反应②和③的顺序不能交换的原因是避免氨基被酸性高锰酸钾氧化;
,甲基被高锰酸钾溶液氧化为羧基,硝基被还原为氨基,由于氨基易被氧化,所以要先把甲基氧化为羧基,然后再还原硝基为氨基,否则氨基会被高锰酸钾溶液氧化,故反应③的反应类型是还原反应;反应②和③的顺序不能交换的原因是避免氨基被酸性高锰酸钾氧化;
(3)Y是 发生缩聚反应生成的高聚物,结构简式为
发生缩聚反应生成的高聚物,结构简式为 ;
;
(4)反应⑤是苯甲醛和银氨溶液发生的银镜反应,离子方程式为![]() +2Ag(NH3)2++2OH-
+2Ag(NH3)2++2OH-![]()
![]() +NH4++H2O+2Ag↓+3NH3;
+NH4++H2O+2Ag↓+3NH3;
(5)阿司匹林 的同分异构体满足如下要求:
的同分异构体满足如下要求:
①芳香族化合物,即分子中有苯环;
②不能发生水解反应,也不能发生银镜反应,即不能有酯基和醛基;
③1mol该有机物最多能与 2 mol NaHCO3完全反应,即分子中有2个羧基。
阿司匹林分子中和苯环相连的共有3个碳原子、4个氧原子和2个不饱和度,满足上述3点要求的同分异构体可以在苯环上连有3个取代基:1个甲基、2个羧基,有6种结构;也可以连有2个取代基:1个羧基和1个-CH2COOH,有3种结构;还可以是只连1个取代基-CH(COOH)2,所以共有10种不同的结构;
(6)A 为 ,要制备
,要制备 ,需要把苯环和氢气加成得到环己烷的衍生物,氯原子可以发生消去,可以形成碳碳双键,然后和卤素单质加成得到邻位二元卤代烃,最后再水解即可。合成路线流程图为
,需要把苯环和氢气加成得到环己烷的衍生物,氯原子可以发生消去,可以形成碳碳双键,然后和卤素单质加成得到邻位二元卤代烃,最后再水解即可。合成路线流程图为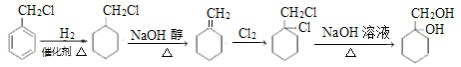 。
。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】钒钛磁铁矿炼钢后剩余的尾渣中含有V2O3、MgO、Al2O3、Fe2O3、SiO2等,现从该钒渣中回收V2O3及少量单质铝的工艺流程如图:
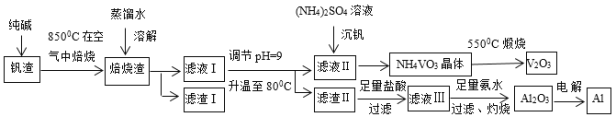
(1)滤液I的成分是NaVO3、NaAlO2和___(写化学式)。
(2)检验滤渣I中含有一种可作红色油漆和颜料的成分的方法是___。
(3)写出“焙烧”时生成NaVO3的化学方程式___。
(4)写出滤液Ⅲ与氨水反应生成沉淀的离子方程式___。
(5)NH4VO3和Na2SO4的混合液需要经过蒸发浓缩、趁热过滤、冷却结晶和过滤等操作得到NH4VO3晶体,结合如图分析,为了得到较纯净的NH4VO3晶体和较高的晶体析出率,应选择最适宜的结晶温度为a、b、c、d四点中___点对应的温度。
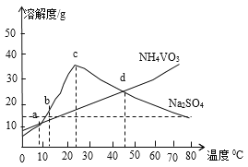
(6)若经过(5)步骤后得到的是粗NH4VO3晶体,则精制NH4VO3晶体需要采用的操作为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:
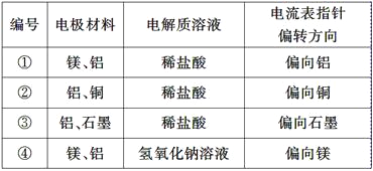
试根据表中的实验现象完成下列问题:
(1)实验①、②中铝所作的电极(指正极或负极)________(填“相同”或“不相同”)。
(2)实验③中铝为________极,电极反应式为_________________________________________;石墨为________极,电极反应式为______________;电池总反应式为____________________。
(3)实验④中铝作负极还是正极?____________,理由是_________________________,铝电极的电极反应式为__________________________________________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一有机化学基础](13分)
对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式 。
(2)PX 可发生的反应有 、 (填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A 是PX的一种同分异构体。

① B 的苯环上存在2 种不同化学环境的氢原子,则B 的结构简式是 。
② D 分子所含官能团是 (填名称)。
③ C 分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是
(4)F 是B 的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;b.遇FeCl3溶液显示特征颜色;c.能与碳酸氢钠溶液反应。
写出F 与NaHCO3溶液反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物的结构与性质密切相关。
①苯属于_____(填字母)
a.芳香烃 b.烯烃 c.炔烃
②鉴别苯和甲苯适宜的试剂是_______(填字母)
a.水 b.KMnO4酸性溶液 c.NaOH溶液
(2)柴胡红景天中的活性成分之一是鞣花酸(结构式如图)。
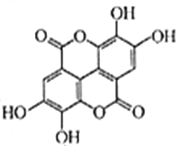
①鞣花酸的分子式为____________
②鞣花酸分子中含氧官能团为_______和______(填名称)
③1moL鞣花酸最多可与__________moL Br2发生取代反应;1moL鞣花酸最多可与含______moL NaOH的溶液发生反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了为锂离子电池发展作出重要贡献的科学家。高能 LiFePO4电池结构如图所示,电池中间为聚合物的隔膜,其主要作用是反应过程中只让Li+通过。已知电池的反应原理:(1-x)LiFePO4+xFePO4+LixCn ![]() LiFePO4+nC,下列说法正确的是
LiFePO4+nC,下列说法正确的是
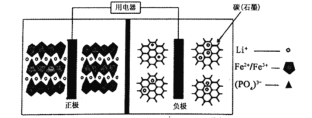
A.充电时,Li+向左移动
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC═LixCn
D.放电时,正极电极反应式:xLiFePO4-xe-═xFePO4+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O35H2O)俗名“大苏打”,又称为“海波”,易溶于水,难溶于乙醇,加热,遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图所示,请回答下列问题。

实验具体操作:
Ⅰ.开启分液漏斗,使浓硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,至微沸。
Ⅱ.直至出现的浑浊不再消失,并控制溶液的pH接近7时,停止通SO2气体。
(1)仪器A的名称为______;B中多孔球泡的作用是______;装置C的作用是______。
(2)为了保证硫代硫酸钠的产量,装置B中溶液pH不能小于7,请用离子方程式解释原因______。
(3)为了尽可能得到较纯的Na2S2O3溶液,三颈烧瓶B中Na2S和Na2CO3的物质的量投料比应该为______。
(4)所得产品中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液等
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③______ | ④有乳黄色沉淀,______ |
⑤静置,取上层清液______ | ⑥______ |
(5)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水配制成100 mL溶液。
②滴定:取0.00950molL-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+═3I2+2Cr3++7H2O.然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-═S4O62-+2I-.加入淀粉溶液作为指示剂,继续滴定,当溶液______,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍-铁碱性电池十分耐用,但其充电过程中正负极得到的产物对电解水有很好的催化作用,因此电池过充时会产生氢气和氧气,限制了其应用。科学家将电池和电解水结合在起,制成新型的集成式电池电解器,可将富余的能量转化为氢能储存。已知镍铁碱性电池总反应方程式为:Fe+2NiOOH+2H2O![]() Fe(OH)2+2Ni(OH)2。下列有关说法错误的是( )
Fe(OH)2+2Ni(OH)2。下列有关说法错误的是( )
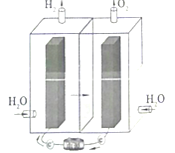
A.电能、氢能属于二次能源
B.该储能装置中的交换膜为阴离子交换膜
C.该装置储氢能发生的反应为:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.镍-铁碱性电池放电时正极的反应为:Ni(OH)2+OH--e-═NiOOH+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com