
【题目】钒钛磁铁矿炼钢后剩余的尾渣中含有V2O3、MgO、Al2O3、Fe2O3、SiO2等,现从该钒渣中回收V2O3及少量单质铝的工艺流程如图:
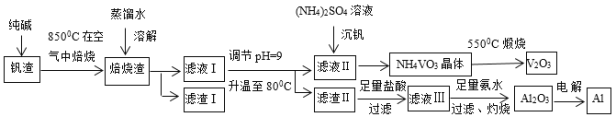
(1)滤液I的成分是NaVO3、NaAlO2和___(写化学式)。
(2)检验滤渣I中含有一种可作红色油漆和颜料的成分的方法是___。
(3)写出“焙烧”时生成NaVO3的化学方程式___。
(4)写出滤液Ⅲ与氨水反应生成沉淀的离子方程式___。
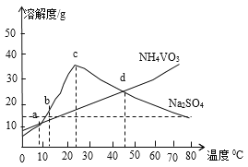
(5)NH4VO3和Na2SO4的混合液需要经过蒸发浓缩、趁热过滤、冷却结晶和过滤等操作得到NH4VO3晶体,结合如图分析,为了得到较纯净的NH4VO3晶体和较高的晶体析出率,应选择最适宜的结晶温度为a、b、c、d四点中___点对应的温度。
(6)若经过(5)步骤后得到的是粗NH4VO3晶体,则精制NH4VO3晶体需要采用的操作为___。
【答案】Na2SiO3 将少量滤渣I溶于稀盐酸中,向溶解后的混合液中滴加KSCN溶液,若溶液变为血红色,说明滤渣中含有Fe2O3 V2O3+O2+Na2CO3![]() 2NaVO3+CO2 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ b 重结晶
2NaVO3+CO2 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ b 重结晶
【解析】
钒钛磁铁矿炼钢后剩余的尾渣中含有V2O3、MgO、Al2O3、Fe2O3、SiO2等,加入纯碱850°C焙烧反应生成NaVO3、NaAlO2和Na2SiO3,MgO、Fe2O3和碳酸钠不反应,加入蒸馏水溶解过滤得到滤渣Ⅰ为MgO、Fe2O3,滤液Ⅰ加入试剂调节溶液PH=9,升温到80°C过滤得到滤渣Ⅱ和滤液Ⅱ,滤液中加入硫酸铵沉钒,得到偏钒酸铵晶体,550°C煅烧得到V2O3;据此分析。
(1)分析可知滤液I的成分是NaVO3、NaAlO2和Na2SiO3;
(2)检验滤渣I中是否含有Fe2O3的方法是:将少量滤渣I浓于稀盐酸中,向溶解后的混合液中滴加KSCN溶液,若溶液变为血红色,说明滤渣中含有Fe2O3;
(3)V2O3生成NaVO3,因为化合价升高被氧化,因此需要氧气作为氧化剂,“焙烧”时生成NaVO3的化学方程式:V2O3+O2+Na2CO3![]() 2NaVO3+CO2;
2NaVO3+CO2;
(4)滤液Ⅲ中含有氯化铝,与氨水反应生成沉淀的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(5) NH4VO3的溶解度随温度升高增大,所以尽可能选择低温条件,但是a点二者的溶解度一样大,适宜选择a、b、c、d四点中b点对应的温度;
(6)精制NH4VO3晶体需要采用的操作为重结晶。


科目:高中化学 来源: 题型:
【题目】下列关于有机物(![]() )的说法错误的是
)的说法错误的是
A.该分子中的5个碳原子可能共面
B.与该有机物含相同官能团的同分异构体只有3种
C.通过加成反应可分别制得烷烃、卤代烃
D.鉴别该有机物与戊烷可用酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氢氧化钡溶液中加入硫酸铵:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1mol/LpH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
B. 将标准状况下的2.24LCO2通入150mL1mol/LNaOH溶液中,所得溶液中c(CO32-)>c(HCO3-)
C. 室温下,c(NH4+)相同的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液浓度大小顺序为:①>②>③
D. 常温时①pH=12的氨水②pH=12的NaOH溶液,将两溶液稀释相同倍数后溶液的pH:②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,正确的是
A.甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol
B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-2akJ/mol
2NH3(g) △H=-2akJ/mol
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
D.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:Mg(s)+2 H2O (g)=Mg(OH )2(s)+H2(g)△H1=﹣441kJmol﹣1
H2O(g)= ![]() H2(g)+O2(g)△H2=242kJmol﹣1
H2(g)+O2(g)△H2=242kJmol﹣1
Mg(s)+ ![]() O2(g)=MgO(s)△H3=﹣602kJmol﹣1
O2(g)=MgO(s)△H3=﹣602kJmol﹣1
①Mg(OH )2分解的热化学方程式为:________.
②Mg(OH )2可以作为阻燃剂的原因(写一条即可)________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共用两个及两个以上碳原子的多环烃称为桥环烃,共用的碳原子称为桥头碳。桥环烃二环[2.2.0]己烷的碳原子编号为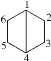 。下列关于该化合物的说法错误的是( )
。下列关于该化合物的说法错误的是( )
A.桥头碳为1号和4号
B.与环己烯互为同分异构体
C.二氯代物有6种(不考虑立体异构)
D.所有碳原子不可能位于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是一种重要的有机化工原料,如图所示是以有机物X为原料设计的合成路线(部分产物、个别合成路线、反应条件等略去)。
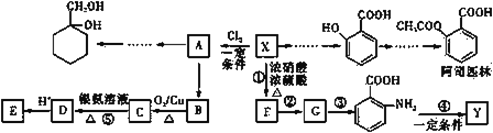
已知:i.X为芳香烃,其相对分子质量为92;Y是一种功能高分子材料。
ii.烷基苯在酸性高酸钾的作用下,侧链被氧化成羧基:
![]()
iii.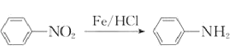 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X 结构简式为______。阿司匹林中官能团的名称为______。
(2)反应③的反应类型是______;反应②和③的顺序不能交换的原因是______。
(3)Y 的结构简式为______。
(4)已知 A 为一氯代物。反应⑤的离子方程式为______。
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有______种。
①芳香族化合物;
②不能发生水解反应,也不能发生银镜反应;
③1mol该有机物最多能与 2 mol NaHCO3完全反应。
(6)写出以 A 为原料制备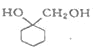 的合成路线流程图(其它试剂任选)_________________。
的合成路线流程图(其它试剂任选)_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com