
【题目】己知:Mg(s)+2 H2O (g)=Mg(OH )2(s)+H2(g)△H1=﹣441kJmol﹣1
H2O(g)= ![]() H2(g)+O2(g)△H2=242kJmol﹣1
H2(g)+O2(g)△H2=242kJmol﹣1
Mg(s)+ ![]() O2(g)=MgO(s)△H3=﹣602kJmol﹣1
O2(g)=MgO(s)△H3=﹣602kJmol﹣1
①Mg(OH )2分解的热化学方程式为:________.
②Mg(OH )2可以作为阻燃剂的原因(写一条即可)________.
【答案】Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81kJmol﹣1 Mg(OH )2分解要吸收大量的热,可以降低着火体系的温度
【解析】
①结合盖斯定律可知b+c-a得到Mg(OH)2(s)=MgO(s)+H2O(g);
②Mg(OH )2分解吸收热量。
(a)Mg(s)+2H2O (g)=Mg(OH )2(s)+H2(g)△H1=﹣441kJmol﹣1
(b)H2O(g)= ![]() H2(g)+O2(g)△H2=242kJmol﹣1
H2(g)+O2(g)△H2=242kJmol﹣1
(c)Mg(s)+ ![]() O2(g)=MgO(s)△H3=﹣602kJmol﹣1
O2(g)=MgO(s)△H3=﹣602kJmol﹣1
①结合盖斯定律可知b+c-a得到Mg(OH )2分解的热化学方程式为:Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81kJmol﹣1 ;
故答案为:Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81kJmol﹣1 ;
②Mg(OH )2可以作为阻燃剂的原因为Mg(OH )2分解要吸收大量的热,可以降低着火体系的温度,
故答案为:Mg(OH )2分解要吸收大量的热,可以降低着火体系的温度。


科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH﹣△H>0,下列叙述正确的是( )
H++OH﹣△H>0,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B.向水中加入氨水,平衡逆向移动,c(OH﹣)降低
C.向水中加入金属钠,平衡正向移动,c(H+)增大
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒钛磁铁矿炼钢后剩余的尾渣中含有V2O3、MgO、Al2O3、Fe2O3、SiO2等,现从该钒渣中回收V2O3及少量单质铝的工艺流程如图:
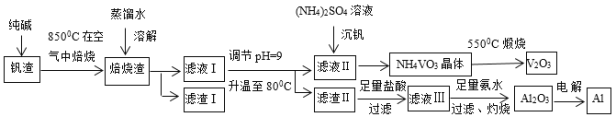
(1)滤液I的成分是NaVO3、NaAlO2和___(写化学式)。
(2)检验滤渣I中含有一种可作红色油漆和颜料的成分的方法是___。
(3)写出“焙烧”时生成NaVO3的化学方程式___。
(4)写出滤液Ⅲ与氨水反应生成沉淀的离子方程式___。
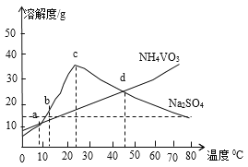
(5)NH4VO3和Na2SO4的混合液需要经过蒸发浓缩、趁热过滤、冷却结晶和过滤等操作得到NH4VO3晶体,结合如图分析,为了得到较纯净的NH4VO3晶体和较高的晶体析出率,应选择最适宜的结晶温度为a、b、c、d四点中___点对应的温度。
(6)若经过(5)步骤后得到的是粗NH4VO3晶体,则精制NH4VO3晶体需要采用的操作为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )

A、12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B、该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ
C、2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
D、该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。

(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
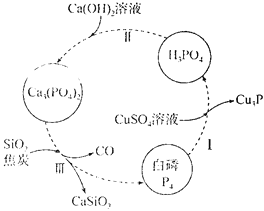
【题目】磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)下图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,被还原的元素是________(填元素符号),过程III的化学方程式为__________。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:
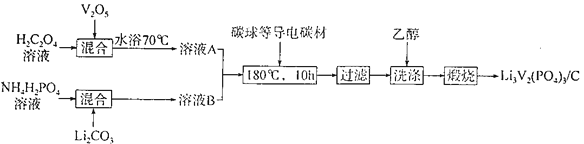
①复合材料中V的化合价为________,C的作用是____________。
②V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为____________;“洗涤”时用乙醇而不用水的目的是________________。
③锂离子电池是一种二次电池,又称“摇椅”电池。若用和LixC6和Li3V2(PO4)3/C做电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3= Li3V2(PO4)3+C6,则电池充电时阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了为锂离子电池发展作出重要贡献的科学家。高能 LiFePO4电池结构如图所示,电池中间为聚合物的隔膜,其主要作用是反应过程中只让Li+通过。已知电池的反应原理:(1-x)LiFePO4+xFePO4+LixCn ![]() LiFePO4+nC,下列说法正确的是
LiFePO4+nC,下列说法正确的是
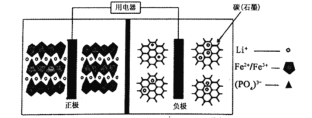
A.充电时,Li+向左移动
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC═LixCn
D.放电时,正极电极反应式:xLiFePO4-xe-═xFePO4+xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com