
����Ŀ�����仯�����ڹ�ũҵ�����о�����Ҫ��;���ش��������⣺
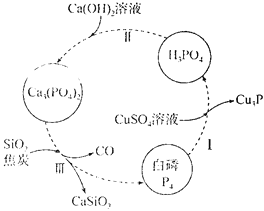
(1)��ͼ��ʾΪ�ᴿ������Ʒ(����������)�Ĺ������̡�����I�У�����ԭ��Ԫ����________(��Ԫ�ط���)������III�Ļ�ѧ����ʽΪ__________��
(2)���ᷰ�/̼���ϲ���[Li3V2(PO4)3/C]�dz��õĵ缫���ϣ����Ʊ��������£�
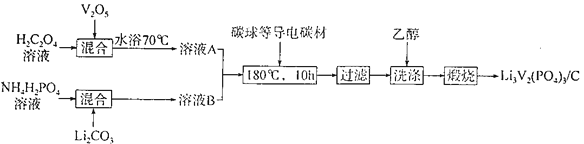
�ٸ��ϲ�����V�Ļ��ϼ�Ϊ________��C��������____________��
��V2O5��H2C2O4��Ӧ����V2(C2O4)3�Ļ�ѧ����ʽΪ____________����ϴ����ʱ���Ҵ�������ˮ��Ŀ����________________��
������ӵ����һ�ֶ��ε�أ��ֳ���ҡ������ء����ú�LixC6��Li3V2(PO4)3/C���缫���ŵ�ʱ�ĵ���ܷ�ӦΪLixC6��Li3��xV2(PO4)3= Li3V2(PO4)3+C6�����س��ʱ�����ĵ缫��ӦʽΪ___________��
���𰸡�Cu��P 2 Ca3(PO4)2+6 SiO2+10C= 6CaSiO3+10CO��+P4 +3 ��ǿ���ϲ��ϵĵ����� V2O5+5H2C2O4= V2(C2O4)3+4CO2��+5H2O ���ٲ�Ʒ��� Li3V2(PO4)3-xe-= Li3��xV2(PO4)3+xLi+
��������
(1)����ͼ����I�а���������ͭ��Һ��Ӧ���������Cu3P������III�з�Ӧ��ΪCa3(PO4)2��SiO2��C��������ΪCaSiO3��CO��P4�����������ԭ��Ӧ�Ĺ��ɷ������
(2)�ٸ��ϲ���Li3V2(PO4)3���Ԫ�ػ��ϼ�Ϊ+1�ۣ����������Ϊ-3�ۣ������������ϼ۵Ĵ�����Ϊ0����V�Ļ��ϼۣ����ݸø��ϲ����dz��õĵ缫���ϣ����C�ǵ��������𣻢�V2O5��H2C2O4��Ӧ����V2(C2O4)3��VԪ�ػ��ϼ۽�����̼Ԫ�ػ��ϼ����ߣ����ɲ����ж�����̼��ˮ�����������ԭ��Ӧ�Ĺ�����д��ѧ����ʽ���۸��ݷŵ���ܷ�Ӧ���Եõ����ʱ��ص��ܷ�Ӧ����ϵ��ԭ���������
(1)����ͼ����I�а���������ͭ��Һ��Ӧ���������Cu3P������PԪ�غ�CuԪ�صĻ��ϼ۽��ͣ�����ԭ������III�з�Ӧ��ΪCa3(PO4)2��SiO2��C��������ΪCaSiO3��CO��P4����Ӧ�Ļ�ѧ����ʽΪ2 Ca3(PO4)2+6SiO2+10C= 6CaSiO3+10CO��+P4���ʴ�Ϊ��Cu��P��2 Ca3(PO4)2+6 SiO2+10C= 6CaSiO3+10CO��+P4��
(2)�����ᷰ�/̼���ϲ���[Li3V2(PO4)3/C]���������-3�ۣ����+1�ۣ����V�Ļ��ϼ�Ϊ+3�ۣ��ø��ϲ����dz��õĵ缫���ϣ�CΪ���壬������ǿ���ϲ��ϵĵ����ԣ��ʴ�Ϊ��+3����ǿ���ϲ��ϵĵ����ԣ�
��V2O5��H2C2O4��Ӧ����V2(C2O4)3������V�Ļ��ϼ���+5�۽���Ϊ+3�ۣ�����ᱻ�������ɶ�����̼�����ݵ�ʧ�����غ��ԭ���غ㣬��Ӧ�Ļ�ѧ����ʽΪV2O5+5H2C2O4= V2(C2O4)3+4CO2��+5H2O��Li3V2(PO4)3 �ܹ�����ˮ����ϴ����ʱ���Ҵ�������ˮ�����Լ��ٲ�Ʒ��ģ��ʴ�Ϊ��V2O5+5H2C2O4= V2(C2O4)3+4CO2��+5H2O�����ٲ�Ʒ��ģ�
�۸�����ӷŵ�ʱ�ĵ���ܷ�ӦΪLixC6��Li3��xV2(PO4)3= Li3V2(PO4)3+C6������ʱ��ص��ܷ�ӦΪLi3V2(PO4)3+C6�TLixC6+Li3-xV2(PO4)3�����ʱ��������������Ӧ���缫��ӦΪ��Li3V2(PO4)3-xe-=Li3-xV2(PO4)3+xLi+���ʴ�Ϊ��Li3V2(PO4)3-xe-=Li3-xV2(PO4)3+xLi+��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L�����������ܱ���������X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��
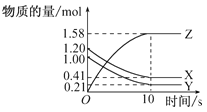
(1)д���÷�Ӧ�Ļ�ѧ����ʽ��________��
(2)�ӷ�Ӧ��ʼ��10s����Z��ʾ�ķ�Ӧ����Ϊ________mol��L-1��s-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�顱���м��ס����㡢��Լ����ɫ���ŵ㣬���й������������ʵ�顱(�г�װ��δ����)��˵����ȷ����(�� ��)
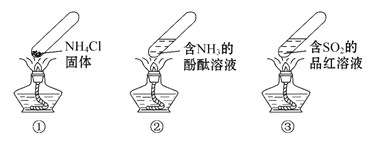
A. ����ʱ�������ϲ��㼯��NH4Cl����
B. ����ʱ��������Һ��죬��ȴ���ֶ���Ϊ��ɫ
C. ����ʱ��������Һ��ɫ��ȥ����ȴ����Һ��죬����SO2��Ư����
D. ���������ʵ�顱���������Ļ�ѧ��Ӧ���ǿ��淴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2SO2(g) + O2(g) ![]() 2SO3(g) ��H =-akJ/mol(a>0),�����仯��ͼ��ʾ������˵������ȷ����
2SO3(g) ��H =-akJ/mol(a>0),�����仯��ͼ��ʾ������˵������ȷ����

A. 2SO2(g) +O2(g) ![]() 2SO3(1) ��H>-a kJ/mol
2SO3(1) ��H>-a kJ/mol
B. ����II����ʹ���˴�����ʹ�ô������������SO2��ƽ��ת����
C. ��Ӧ��ϼ���������֮��С��������ɼ��ͷ�����֮��
D. ��2molS02(g)��1 mol 02(g)����һ�ܱ������г�ַ�Ӧ��ų�������С��a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MOH��ROH����һԪ�����Һ�ֱ��ˮϡ�ͣ�pH�仯��ͼ�����������в���ȷ����( )

A. ROH��һ��ǿ��
B. ��x�㣬MOH����ȫ����
C. ��x��C(M+)��C(R+)
D. ϡ��ǰC(ROH) �� 10 C(MOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѪҺ�ڵ�Ѫ�쵰�ף�Hb������O2�������HbO2����˾�������������CO������з�����Ӧ��CO+HbO2![]() O2+HbCO��37��ʱ���÷�Ӧ��ƽ�ⳣ��K=220��HbCO��Ũ�ȴﵽHbO2Ũ�ȵ�0.02������ʹ�������������н��۴�����ǣ� ��
O2+HbCO��37��ʱ���÷�Ӧ��ƽ�ⳣ��K=220��HbCO��Ũ�ȴﵽHbO2Ũ�ȵ�0.02������ʹ�������������н��۴�����ǣ� ��
A. CO��HbO2��Ӧ��ƽ�ⳣ��K=![]()
B. �������CO��O2Ũ��֮�ȴ��ڻ����0.02ʱ���˵������Ż�����
C. ���������COԽ�࣬��Ѫ�쵰��ϵ�O2Խ��
D. ��CO�ж��IJ��˷����ѹ�����нⶾ����ԭ����ʹ����ƽ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A.5.6 g Fe��������������ȫ��Ӧʧȥ������Ϊ0.3 NA
B.���³�ѹ�£�100 g��������Ϊ17% ��H2O2��Һ�к���ԭ����ĿΪNA
C.4.4gCO2������Na2O2��Ӧת�Ƶ�����Ϊ0.1NA
D.����£�4.48L��ˮ�к���H2O���ӵ���ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ�Ԫ��(��I-��ʽ����)��ʵ��������ȡ���������ͼ��
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() �D��
�D��![]()
��1��ʵ������۵�������__��������Ҫ��������Ϊ__��
��2����ȡ��Ĺ����У��ɹ�ѡ����л��Լ���___(����)��ѡ���������___��
A.�ƾ�(�е�78��) B.���Ȼ�̼(�е�77��)
C.����(�е�290��) D.��(�е�80��)
��3���ӵ���л���Һ�еõ����ʵ�ķ�����___��
��4����������պ���ʱ������Ҫ���ż��⣬����Ҫ�õ���ʵ��������__(������������ѡ�����������������ĸ��д�ڿհ״�)��
A.�ձ� B.���� C.������ D.������ E.�ƾ��� F.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ���һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ��

����Ҫ��ش�������⣺
��1��ͨ�������ĵ缫Ϊ___�������������������������������ĵ缫��ӦʽΪ__��
��2��ʯī�缫(C)�缫Ϊ___��������������������������Fe�缫�ĵ缫��ӦʽΪ__��
��3����Ӧһ��ʱ�����װ������������������Ҫ��__��������������������ʯī������
��4�������ͭ�к���п���������ʣ����װ���з�Ӧһ��ʱ�������ͭ��ҺŨ�Ƚ�__����������������С����������������
��5�����ڱ�״���£���4.48L�����μӷ�Ӧ������װ�������缫�����ɵ�����ķ�����Ϊ__����װ������������ͭ������Ϊ__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com