
【题目】MOH和ROH两种一元碱的溶液分别加水稀释,pH变化如图。下列叙述中不正确的是( )

A. ROH是一种强碱
B. 在x点,MOH已完全电离
C. 在x点C(M+)=C(R+)
D. 稀释前C(ROH) = 10 C(MOH)
【答案】BD
【解析】
根据图中信息,稀释100倍时,ROH溶液的PH由13降到11,说明ROH为一元强碱;MOH溶液的PH由12降到11,说明MOH为一元弱碱。
A.根据以上分析可知,ROH是一种强碱,故A正确;
B.根据以上分析可知,MOH是一元弱碱,不可能完全电离,故B错误;
C.利用电荷守恒C(M+)=C(OH)-C(H+), C(R+)=C(OH)-C(H+),由于两种溶液在x点PH相同,所以OH-与H+的浓度相同,所以C(M+)=C(R+),故C正确;
D.稀释前ROH溶液的PH为13,C(R+)=-0.1mol/l,MOH溶液的PH为12,但MOH为弱碱,C(M+)>0.01mol/l,则C(ROH)< 10C(MOH),故D错误;
正确答案:BD。


科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A. S![]() SO3
SO3![]() H2SO4
H2SO4
B. NH3![]() NO2
NO2![]() HNO3
HNO3
C. Cu2(OH)2CO3![]() CuCl2(aq)
CuCl2(aq)![]() Cu(s)
Cu(s)
D. 饱和NaCl溶液![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。

请回答下列问题:
①图中A点表示:__________________________。
C点表示:______________________________。
E的大小对该反应的反应热______(填“有”或“无”)影响。
②25℃、101 kPa下测得,2mol SO2和1 mol O2充分反应放出热量________198 kJ(填“大于”、“等于”或“小于”)。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:_____________________________。
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g)+![]() O2(g)
O2(g)![]() H2O( l )的ΔH =________________kJ/mol。
H2O( l )的ΔH =________________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是产生和收集气体的实验装置,该装置适合于( )

A.用浓硝酸与Cu反应制取NO2B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2D.用NH4Cl和Ca (OH)2反应制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)下图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,被还原的元素是________(填元素符号),过程III的化学方程式为__________。
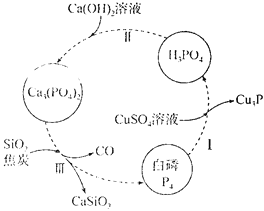
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:
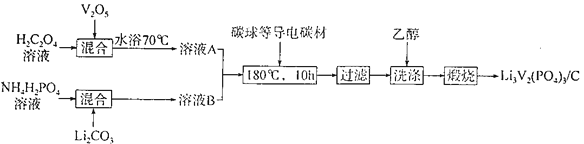
①复合材料中V的化合价为________,C的作用是____________。
②V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为____________;“洗涤”时用乙醇而不用水的目的是________________。
③锂离子电池是一种二次电池,又称“摇椅”电池。若用和LixC6和Li3V2(PO4)3/C做电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3= Li3V2(PO4)3+C6,则电池充电时阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56g铜粉加入100mL0.4mol·L-1的稀HNO3溶液中,加热充分反应后再加入100mL0.2mol·L-1的H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )
A.0.15mol·L-1B.0.2mol·L-1C.0.075mol·L-1D.0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。用化学用语回答下列问题:
(1)F在元素周期表中的位置为__。
(2)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。H的电子式为___,写出在空气中长期放置生成H的化学反应方程式为:__。
(3)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。

则曲线Y表明M中的溶质为___;原NaOH溶液的物质的量浓度为__;由曲线X、Y可知,两次实验通入的CO2的体积比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
Ⅰ.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则N2(g)+3H2(g)=2NH3(g) ΔH=______________
Ⅱ.下图是镁铝原电池请写出甲的电池总反应______________ ,乙池铝极的电极反应式______________

Ⅲ.下图是一个化学过程的示意图,回答下列问题:

(1)乙装置中电极A的名称是__________
(2)甲装置中通入CH4的电极反应式为 ________________________________________________
(3)一段时间,当丙池中产生224 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________(已知:NaCl溶液足量,电解后溶液体积为1000 mL)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com