
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
Ⅰ.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则N2(g)+3H2(g)=2NH3(g) ΔH=______________
Ⅱ.下图是镁铝原电池请写出甲的电池总反应______________ ,乙池铝极的电极反应式______________

Ⅲ.下图是一个化学过程的示意图,回答下列问题:

(1)乙装置中电极A的名称是__________
(2)甲装置中通入CH4的电极反应式为 ________________________________________________
(3)一段时间,当丙池中产生224 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________(已知:NaCl溶液足量,电解后溶液体积为1000 mL)。
【答案】-92.4 kJ·mol-1 Mg+2H+ =Mg2+ +H2↑ 2Al-6e-+8OH-=2AlO2-+4H2O 阳极 CH4+10OH--8e-=CO32-+7H2O 12
【解析】
Ⅰ.(1)反应的焓变△H=反应物键能总和-生成物键能总和计算;
Ⅱ. 镁铝原电池,图甲中,电解质溶液为硫酸,则根据金属活动性顺序判断电源负极为镁,图乙中,电解质溶液为氢氧化钠,铝与氢氧化钠发生自发的氧化还原反应,故铝做负极,据此分析作答;
Ⅲ. (1)甲池为甲烷形成的燃料电池;根据原电池的正负极判断乙装置电解池的阴阳极;
(2)CH4在负极上失电子,碱性条件下生成碳酸根;
(3)电解氯化钠溶液时,阴极上氢离子放电,阳极上氯离子放电,根据氯气、氢气和氢氧化钠的关系式计算氢氧化钠的物质的量浓度,从而得出溶液的pH。
Ⅰ. N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1,N2(g)+3H2(g)=2NH3(g) ΔH=反应物键能总和生成物键能总和 = 948.9 kJmol1+3×436.0 kJmol16×391.55 kJmol1 =-92.4 kJ·mol-1,
故答案为:-92.4 kJ·mol-1;
Ⅱ. 图甲的原电池装置中,镁做负极,被氧化,铝电极做正极,氢离子被还原,其总的电池反应式为:Mg+2H+ =Mg2+ +H2↑;在图乙中,铝与氢氧化钠溶液反应,Al为原电池的负极,被氧化,故电极反应式为:2Al-6e-+8OH-=2AlO2-+4H2O,
故答案为:Mg+2H+ =Mg2+ +H2↑;2Al-6e-+8OH-=2AlO2-+4H2O;
Ⅲ. (1)甲池中一极通入甲烷,另一极通入氧气,所以甲池为甲烷形成的燃料电池,通入甲烷的一极为负极,通入氧气的一极为正极,A与正极相连,所以A的名称为阳极;
故答案为:阳极;
(2)CH4在负极上失电子,碱性条件下生成碳酸根,所以甲装置中通入CH4的电极反应式为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;
(3)丙池中发生的反应为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,丙池中产生224 mL,则氢气的体积与氯气的体积相同均为112 mL,其物质的量为
2NaOH+H2↑+Cl2↑,丙池中产生224 mL,则氢气的体积与氯气的体积相同均为112 mL,其物质的量为![]() = 0.005 mol,根据H2
= 0.005 mol,根据H2![]() 2NaOH关系式得n(NaOH)=2×0.005 mol = 0.01 mol,故c(OH-) =
2NaOH关系式得n(NaOH)=2×0.005 mol = 0.01 mol,故c(OH-) = ![]() = 0.01 mol/L,根据水的离子积c(H+) =
= 0.01 mol/L,根据水的离子积c(H+) = ![]() = 10-12 mol/L,所以溶液的pH=12,
= 10-12 mol/L,所以溶液的pH=12,
故答案为:12。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】MOH和ROH两种一元碱的溶液分别加水稀释,pH变化如图。下列叙述中不正确的是( )

A. ROH是一种强碱
B. 在x点,MOH已完全电离
C. 在x点C(M+)=C(R+)
D. 稀释前C(ROH) = 10 C(MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中正确的是
A. 相同浓度的三种溶液:①(NH4)2CO3溶液、②NH4HCO3溶液、③NH4NO3溶液中 c(NH4+):③>①>②
B. 相同pH的溶液:①NaClO溶液、②NaHCO3溶液、③CH3COONa溶液中 c(Na+):③>②>①
C. 同浓度、同体积的溶液:①CH3COONa溶液、②NH4Cl溶液、③NaNO3溶液中 pH:②>③>①
D. 相同浓度的溶液:①氨水、②NaOH溶液、③Ba(OH)2溶液 c(H+):②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
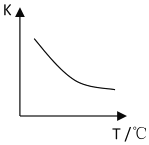
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氢气的电极为___(填“正极”或“负极”),正极的电极反应式为__。
(2)石墨电极(C)电极为___(填“阳极”或“阴极”),Fe电极的电极反应式为__。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在__区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,则丙装置中反应一段时间后,硫酸铜溶液浓度将__(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有4.48L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为__;丙装置中阴极析出铜的质量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源(左池),以Al作阳极、Pb作阴极,电解稀硫酸(右池),使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O ![]() Al2O3+3H2↑。
Al2O3+3H2↑。
关闭K,电解过程中,以下判断正确的是

A. 两池中H+均移向Pb电极
B. 左池每消耗3 mol Pb,右池生成2 mol Al2O3
C. 左池Pb电极质量增加,右池Pb电极质量不变
D. 左池正极反应:PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:

(1)该反应的化学方程式为___________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆) (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为_____________。
(2)反应前A的物质的量浓度是_________。
(3)10 s末,生成物D的浓度为________。
(4)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____;②增大A的浓度_____;③恒容下充入氖气________。
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号)_________。
A.v(B)=2v(C)
B.容器内压强不再发生变化
C.A的体积分数不再发生变化
D.器内气体密度不再发生变化
E.相同时间内消耗n mol的B的同时生成2n mol的D
(6)将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)NH3(g)+HI(g),2HI(g)H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5mol·L1,c(HI)=4mol·L1,则NH3的浓度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com