
����Ŀ����������ƣ�Na2S2O35H2O�����������մ������ֳ�Ϊ����������������ˮ���������Ҵ������ȣ�������ֽ⡣ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ���ͼ��ʾ����ش��������⡣

ʵ����������
������Һ©����ʹŨ�����������£��ʵ����ڷ�Һ©���ĵ��٣�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ�����綯������������ˮԡ���ȣ����С�
��ֱ�����ֵĻ��Dz�����ʧ����������Һ��pH�ӽ�7ʱ��ֹͣͨSO2���塣
��1������A������Ϊ______��B�ж�����ݵ�������______��װ��C��������______��
��2��Ϊ�˱�֤��������ƵIJ�����װ��B����ҺpH����С��7���������ӷ���ʽ����ԭ��______��
��3��Ϊ�˾����ܵõ��ϴ���Na2S2O3��Һ��������ƿB��Na2S��Na2CO3�����ʵ���Ͷ�ϱ�Ӧ��Ϊ______��
��4�����ò�Ʒ�г��������������ʣ�ѡ�������Լ����ʵ�鷽�����м��飺
�Լ���ϡ���ᡢϡH2SO4��BaCl2��Һ��Na2CO3��Һ��
ʵ�鲽�� | ���� |
��ȡ������Ʒ�������������ˮ | �ڹ�����ȫ�ܽ����ɫ������Һ |
��______ | �������ɫ������______ |
�ݾ��ã�ȡ�ϲ���Һ______ | ��______ |
��5������K2Cr2O7����Һ�����ⶨ��������ƵĴ��ȡ��ⶨ�������£�
����Һ���ƣ���ȡ1.2000gij��������ƾ�����Ʒ��������в���ȴ������ˮ���Ƴ�100 mL��Һ��
�ڵζ���ȡ0.00950molL-1��K2Cr2O7����Һ20.00mL�������ữ��������KI��������Ӧ��Cr2O72-+6I-+14H+�T3I2+2Cr3++7H2O��Ȼ���������������Ʒ��Һ�ζ���������ɫ��������Ӧ��I2+2S2O32-�TS4O62-+2I-�����������Һ��Ϊָʾ���������ζ�������Һ______����Ϊ�յ㡣ƽ�еζ�3�Σ���Ʒ��Һ��ƽ������Ϊ24.80 mL������Ʒ����Ϊ______%������1λС������
���𰸡�������ƿ ������������Һ�ĽӴ�������ӿ췴Ӧ���ʣ��������SO2 ���ն���SO2���������� S2O32����2H��=S����SO2����H2O 2��1 ȡ������������Һ���������ϡ���� �д̼�����ζ���������� ����BaCl2��Һ ������ɫ���� ��ɫ��ȥ���Ұ���Ӳ���ԭ 95.0
��������
װ��A�Ʊ�SO2������Na2SO3��H2SO4(Ũ)=Na2SO4��SO2����H2O��װ��B�Ʊ�Na2S2O3��SO2�ж���Ϊ��ֹ��Ⱦ��������Ҫβ����������װ��C�����������ն����SO2��
(1)�������죬��������A�����ƣ���Ϊ��������Һ��ķ�Ӧ�������Ҫ�������ֱ����սǶȽ��з�����
(2)��������������ֽ���з�����
(3)װ��B�����ķ�Ӧ��4SO2��2Na2S��Na2CO3=CO2��3Na2S2O3��Ȼ����з�����
(4)��Ʒ�л��������ƣ���Ҫ����SO42�����ڣ�����Na2S2O3����ֽ⣬ע��������SO42���Ը�ʵ��ĸ��ţ�
(5)��ʹ��Na2S2O3�ζ�I2��������Һ��ָʾ����������ɫ�仯��
�ڽ�����ϵʽ�����з������㣻
(1)��������A���ص㣬����AΪ������ƿ��B�ж�����ݵ���������SO2��Һ��ĽӴ�������ӿ췴Ӧ���������SO2��SO2�ж�����Ⱦ��������Ҫβ�����գ�װ��C�����������ն���SO2������������
(2)����������Ϣ����������������ֽ⣬��pHС��7ʱ������S2O32����2H��=S����SO2����H2O��
(3)װ��B�з����ķ�Ӧ��4SO2��2Na2S��Na2CO3=CO2��3Na2S2O3����Ҫ���շ�Ӧ����ʽϵ����ֵͶ�룬��ý�Ϊ������Na2S2O3����Na2S��Na2CO3�����ʵ���Ͷ�ϱ�Ϊ2��1��
(4)����Na2SO4����Ҫ����SO42������Ҫ��ȥNa2S2O3��ͬʱ��������SO42���������������ˮ����Ҫ�������ᣬ����S2O32����2H��=S����SO2����H2O�������ɫ���������д̼�����ζ���������ɣ����ú�ȡ�ϲ���Һ������BaCl2��Һ���а�ɫ�������ɣ�
(5)�ٵ������ⵥ�ʱ�������Na2S2O3�ζ��ⵥ�ʣ�������Һ��ָʾ������Һ����ɫ���ζ���������ɫ����ȥ�����ζ��յ���������ɫ��ȥ���Ұ���Ӳ��ָ�ԭ������ɫ��
�ڸ��ݷ�Ӧ��ϵ��������ϵʽCr2O72����3I2��6S2O32������Ʒ��n(S2O32��)=![]() ����Ʒ�Ĵ�����
����Ʒ�Ĵ�����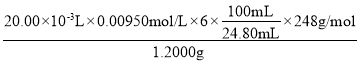 ��100%==95.0%��
��100%==95.0%��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������̼ԭ�ӵĶ����Ϊ�Ż��������õ�̼ԭ�ӳ�Ϊ��ͷ̼���Ż�������[2.2.0]�����̼ԭ�ӱ��Ϊ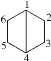 �����й��ڸû������˵��������ǣ�������
�����й��ڸû������˵��������ǣ�������
A.��ͷ̼Ϊ1�ź�4��
B.�뻷��ϩ��Ϊͬ���칹��
C.���ȴ�����6�֣������������칹��
D.����̼ԭ�Ӳ�����λ��ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X��һ����Ҫ���л�����ԭ�ϣ���ͼ��ʾ�����л���XΪԭ����Ƶĺϳ�·�ߣ����ֲ������ϳ�·�ߡ���Ӧ��������ȥ����
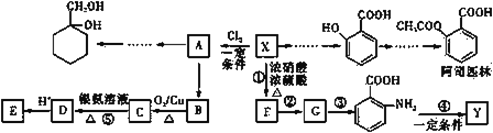
��֪��i.XΪ������������Է�������Ϊ92��Y��һ�ֹ��ܸ߷��Ӳ��ϡ�
ii.����������Ը���ص������£��������������Ȼ���
![]()
iii. ���������ױ�������
���������ױ�������
����ݱ���������Ϣ����ѧ֪ʶ�ش��������⣺
��1��X �ṹ��ʽΪ______����˾ƥ���й����ŵ�����Ϊ______��
��2����Ӧ�۵ķ�Ӧ������______����Ӧ�ں͢۵�˳���ܽ�����ԭ����______��
��3��Y �Ľṹ��ʽΪ______��
��4����֪ A Ϊһ�ȴ����Ӧ�ݵ����ӷ���ʽΪ______��
��5����˾ƥ���ж���ͬ���칹�壬��������������ͬ���칹����______�֡�
�ٷ����廯���
�ڲ��ܷ���ˮ�ⷴӦ��Ҳ���ܷ���������Ӧ��
��1mol���л���������� 2 mol NaHCO3��ȫ��Ӧ��
��6��д���� A Ϊԭ���Ʊ�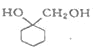 �ĺϳ�·������ͼ�������Լ���ѡ��_________________��
�ĺϳ�·������ͼ�������Լ���ѡ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ú�̼������ϳ�ȼ���ǽ����ԴΣ������Ҫ��������֪CO(g)��2H2(g)![]() CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ� ��
CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ� ��
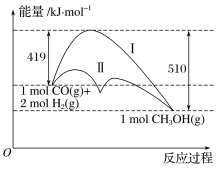
A.�÷�Ӧ�Ħ�H����91kJ��mol��1
B.��Ӧ����ܼ���С����������ܼ���
C.������������Լ�С����Ӧ�Ļ�ܣ������淴Ӧ�Ļ��
D.����÷�Ӧ����Һ̬CH3OH����H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ʱ��0.1mo1/LijһԪ��HA��ˮ����0.1���������룬��������������ǣ�
A. ����Һ��pH=4 B. �����¶ȣ���Һ��pH���� C. ����ĵ���ƽ�ⳣ��ԼΪ1��10-7 D. ��HA�������c(H+)ԼΪˮ�������c(H+)��106��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2011��9��23�գ��й���ѧ�������ϻ����������˹��ҽѧ�����ٴ�ҽѧ����������������Ϊ��������������һ����������ű����ҩ������ȫ���ر��Ƿ�չ�й��ҵ��������˵�����������ͼ�������صĽṹ�����й������ص�˵���в���ȷ����:

A.�����ط���ʽΪC15H22O5
B.����������O��O�������н�ǿ��������
C.������������ˮ���Ҵ�����
D.�������ڼ�������������ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5������������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɣ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

�״������Ѻ�3��5�������������ӵIJ����������ʼ��±���
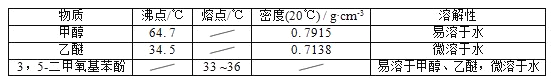
��1����Ӧ�������ȷ�����״����ټ������ѽ�����ȡ���ٷ�����״��IJ����ǵ�______������ȡ�õ��ķ�Һ©��ʹ��ǰ��__________________��ϴ������Һʱ�л����ڷ�Һ©����________����ϡ����¡����㣻
��2������õ����л��������ñ���NaHCO3��Һ������ʳ��ˮ����������ˮ����ϴ�ӣ��ñ���NaHCO3��Һϴ�ӵ�Ŀ����__���ñ���ʳ��ˮϴ�ӵ�Ŀ����______��
��3��ϴ����ɺ�ͨ�����²������롢�ᴿ�����ȷ�IJ���˳����__������ĸ����
a�������ȥ���� b���ؽᾧ c�����˳�ȥ����� d��������ˮCaCl2����
��4����Һ���볣���ü�ѹ���ˣ�Ϊ�˷�ֹ��������ѹ������ɺ�Ӧ��________________����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ���ǣ� ��
A.��AgCl��AgBr�ı�����Һ�м�������AgNO3����Һ��![]() ����
����
B.��CH3COONa��Һ��20��������30�棬��Һ��![]() ����
����
C.�������м��백ˮ�����ԣ���Һ��![]() ��1
��1
D.��0.1molL-1CH3COOH ��Һ�м�������ˮ����Һ�� ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ͼ��Ӧ���ǣ� ��
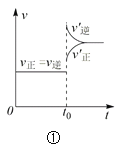
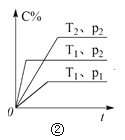
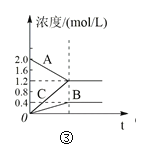
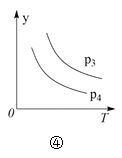
A.���ڴﵽƽ��״̬��N2(g) + 3H2(g) 2NH3(g)��ͼ�ٱ�ʾ��t0ʱ�̳�����һ������NH3��ƽ�������ƶ�
B.��ͼ�ڿ�֪��p2 > p1��T1 > T2���㷴Ӧ��2A(g) + B(g) 2C(g) ��H < 0
C.ͼ�۱�ʾ�ķ�Ӧ����ʽΪ2A = B + 3C
D.���ڷ�Ӧ2X(g) + 3Y(g) 2Z(g) ��H < 0��ͼ��y����Ա�ʾY�İٷֺ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com