
【题目】2011年9月23日,中国科学家屠呦呦获得了美国拉斯克医学奖的临床医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。下图是青蒿素的结构,则有关青蒿素的说法中不正确的是:

A.青蒿素分子式为C15H22O5
B.青蒿素有—O—O—键具有较强的氧化性
C.青蒿素易溶于水、乙醇、苯
D.青蒿素在碱性条件下易发生水解反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H = -169kJ·mol-1,②C(s)+
O2(g)=Cu2O(s)△H = -169kJ·mol-1,②C(s)+![]() O2(g)=CO(g)△H = -110.5kJ·mol-1,③ Cu(s)+
O2(g)=CO(g)△H = -110.5kJ·mol-1,③ Cu(s)+![]() O2(g)=CuO(s)△H = -157kJ·mol-1,则方法a发生的热化学方程式是:____________。
O2(g)=CuO(s)△H = -157kJ·mol-1,则方法a发生的热化学方程式是:____________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为____离子交换膜(填“阴”或“阳”),该电池的阳极反应式为_____,钛极附近的pH值________(填“增大”“减小”或“不变”)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:![]() △H>0。水蒸气的浓度随时间t变化如下表所示:
△H>0。水蒸气的浓度随时间t变化如下表所示:
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | p>T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
①对比实验的温度:T2_________T1(填“﹥”“﹤”或“﹦”),能否通过对比实验①③到达平衡所需时间长短判断:_________(填 “能”或“否”)。
②实验①前20 min的平均反应速率 v(O2)=_________
③催化剂的催化效率:实验①___________实验②(填“﹥”或“﹤”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物的结构与性质密切相关。
①苯属于_____(填字母)
a.芳香烃 b.烯烃 c.炔烃
②鉴别苯和甲苯适宜的试剂是_______(填字母)
a.水 b.KMnO4酸性溶液 c.NaOH溶液
(2)柴胡红景天中的活性成分之一是鞣花酸(结构式如图)。
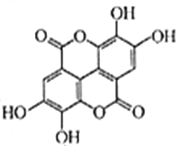
①鞣花酸的分子式为____________
②鞣花酸分子中含氧官能团为_______和______(填名称)
③1moL鞣花酸最多可与__________moL Br2发生取代反应;1moL鞣花酸最多可与含______moL NaOH的溶液发生反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq) ΔH。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
I3-(aq) ΔH。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
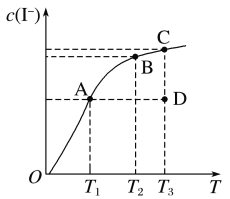
A.该反应ΔH>0
B.若反应进行到状态D时,一定有v正>v逆
C.若在T1、T2温度下,反应的平衡常数分别为K1、K2,则K1>K2
D.状态A与状态B相比,状态A的c(I3-)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O35H2O)俗名“大苏打”,又称为“海波”,易溶于水,难溶于乙醇,加热,遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图所示,请回答下列问题。

实验具体操作:
Ⅰ.开启分液漏斗,使浓硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,至微沸。
Ⅱ.直至出现的浑浊不再消失,并控制溶液的pH接近7时,停止通SO2气体。
(1)仪器A的名称为______;B中多孔球泡的作用是______;装置C的作用是______。
(2)为了保证硫代硫酸钠的产量,装置B中溶液pH不能小于7,请用离子方程式解释原因______。
(3)为了尽可能得到较纯的Na2S2O3溶液,三颈烧瓶B中Na2S和Na2CO3的物质的量投料比应该为______。
(4)所得产品中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液等
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③______ | ④有乳黄色沉淀,______ |
⑤静置,取上层清液______ | ⑥______ |
(5)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水配制成100 mL溶液。
②滴定:取0.00950molL-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+═3I2+2Cr3++7H2O.然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-═S4O62-+2I-.加入淀粉溶液作为指示剂,继续滴定,当溶液______,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(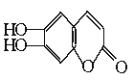 碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
A. 3mol Br22mol NaOH B. 3mol Br24mol NaOH
C. 2mol Br23mol NaOH D. 4mol Br24mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
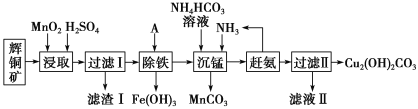
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____。
(5)“赶氨”时,最适宜的操作方法是____。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)可用作还原剂,印染媒染剂、食品防腐剂等。一种湿法制备焦亚酸钠的工艺流程如图。
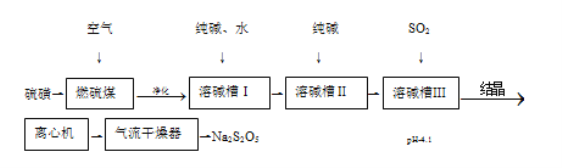
已知:过饱和NaHSO3溶液经结晶、离心分离、干燥制得Na2S2O5。
(1)硫磺先加热成液态后喷人燃硫炉中,作用是__。
(2)“净化”需要除去的杂质气体是__。
(3)溶碱槽Ⅰ中需要通入足量SO2,若SO2不足,则生成__。
(4)溶碱槽Ⅲ中反应的化学方程式为__。
(5)离心机分离后的母液需要返回到溶碱槽__循环使用(填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(6)气流干燥器中发生的化学方程式为__。
(7)为了测定所得产品中Na2S2O5的百分含量,取m克样品加水溶解,用cmol·L-1的碘标准液滴定到终点消耗碘标准液VmL.该产品中Na2S2O5的百分含量为__(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A.苯和氯气生成C6H6Cl6的反应是取代反应
B.可以用溴水鉴别苯和四氯化碳溶液
C.等物质的量的甲烷与氯气反应,有机产物只有CH3Cl
D.1mol![]() 最多可与4molH2发生加成
最多可与4molH2发生加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com