
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、![]()
B.使紫色石蕊溶液变红的溶液中:![]() 、Ba2+、
、Ba2+、![]() 、Cl-
、Cl-
C.pH=12的溶液中:K+、Na+、CH3COO-、Br-
D.滴加几滴KSCN溶液显血红色的溶液中:![]() 、Mg2+、I-、Cl-
、Mg2+、I-、Cl-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
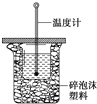
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值__________(填“偏大”、“偏小”或“无影响”);
(3)实验中改用60mL 0.50mol/L 盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热_______(填“相等”或“不相等”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。请回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是___。
(2)为探究(NH4)2Cr2O7(摩尔质量为252g/mol)的分解产物,按如图连接好装置,在A中加入5.040g样品进行实验。
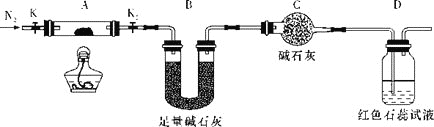
①连接好装置,点燃酒精灯之前,需进行的必要操作是___。
②反应结束后,依然要通一段时间的氮气的原因是___。
③加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44g,写出重铬酸铵加热分解反应的化学方程式:___。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mo1(CH2)6N4H+与1mo1H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600g,配成500mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20.00mol·L-1的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200mo1L-1NaOH标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为20.00mL。
①若滴定终点时,仰视读数,则测定结果___(填“偏大”“偏小”或“无影响”)。
②滴定计算得该样品中N的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下气体反应达到化学平衡,平衡常数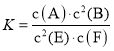 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)A(g)+2B(g)
D.正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种清洁、高效新能源, 也是重要的化工原料。
(1)通过热化学循环在较低温度下由硫化氢分解制备氢气的反应系统原理为:
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-151kJmol-1
2HI(aq)=H2(g)+I2(s) H2=+110kJmol-1
H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) H3=+61kJmol-1
(热化学硫碘循环硫化氢分解联产氢气、硫磺系统)
通过计算可知,该系统制氢的热化学方程式为___________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为CO(g)+2H2(g)CH3OH(g)ΔH= -116 kJ·mol-1。如图表示CO的平衡转化率(α)随温度和压强变化的示意图:
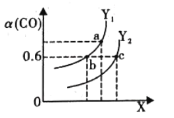
①X 表示的是______ (填“温度”或“压强”) ,理由是_________;Y1______Y2 (填“<”、“ >”或“=”)
②在2L恒容密闭容器中充入2 mol CO 和4 mol H2,一定条件下经过10 min 达到平衡状态c 点处。在该条件下,从开始至达到平衡状态v(CH3OH) =______ molL-1min -1,平衡常数K=________(填最简分数)。平衡常数Ka、Kb、Kc的大小关系是______
③下列措施既能增大反应速率又能提高反应物转化率的是______ (填字母)。
A. 使用催化剂 B. 及时分离CH3OH C.升高温度 D.增大压强
(3) 已知燃料电池的比能最与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由大到小的顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出了具有自主知识产权的治疗缺血性脑梗死新药——丁苯酞。有机物G是合成丁苯酞的中间产物,G的一种合成路线如下:

已知:
回答下列问题:
(1)A的结构简式是___________,E的化学名称是____________。
(2)由B生成C的化学方程式为______________________。
(3)G的结构简式为__________________。合成丁苯酞的最后一步转化为:
 ,则该转化的反应类型是_______________。
,则该转化的反应类型是_______________。
(4)有机物D的溴原子被羟基取代后的产物J有多种同分异构体,其中含有苯环的同分异构体有______种(不包括J),其核磁共振氢谱吸收峰最多的结构简式为_________。
(5)参照题中信息和所学知识,写出用![]() 和CH3MgBr为原料(其他无机试剂任选)制备
和CH3MgBr为原料(其他无机试剂任选)制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在产生了AgCl沉淀的试管中,加入KI溶液,白色沉淀变为黄色。下列说法正确的是( )
A.该实验说明I-还原性比Cl-强B.该实验说明Ksp(AgCl)<Ksp(AgI)
C.该实验说明AgI溶解度比AgCl小D.KI的加入对AgCl的溶解平衡没有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])在工业上主要应用于制药、电镀、造纸、钢铁生产,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。回答下列问题:
(1)Fe3+比Fe2+稳定的原因______。
(2)在[Fe(CN)6]3-中不存在的化学键为______。
A.离子键
B.配位键
C.氢键
D.共价键
(3)已知(CN)2性质与卤素相似,化学上称为类卤化合物。
(CN)2+2 KOH═KCN+KCNO+H2O
KCN+HCl═HCN+KCl
C2H2+HCN→CH2=CH-C≡N
①KCNO中各元素原子的第一电离能由大到小排序为______。
②丙烯腈(CH2=CH-C≡N)分子中碳原子轨道杂化类型是______,分子中σ键和π键数目之比为______。
(4)氮化铁晶体的晶胞结构如图1所示,该晶体中铁、氮的微粒个数之比为______。
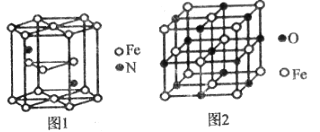
(5)已知:氧化亚铁晶体的密度为pgcm-3,NA表示阿伏加德罗常数的值。氧化亚铁晶体的晶胞如图2所示,该晶胞中,与O2-紧邻且等距离的O2-数目为______;Fe2+与O2-的最短核间距为______pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com