
【题目】科研人员借助太阳能,将H2S转化为可再利用的S和H2的工作原理如图所示。下列叙述错误的是( )
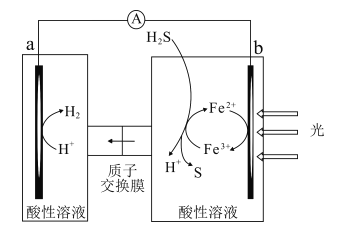
A.该电池能实现将光能转化为化学能
B.a电极的电极反应:2H++2e-=H2↑
C.光照后,b电极的电极反应:H2S-2e-=2H++S
D.a电极区溶液的pH不变
科目:高中化学 来源: 题型:
【题目】为证明醋酸是弱电解质,下列方法不正确的是( )
A.比较相同物质的量浓度的NaOH溶液和醋酸溶液恰好反应完全时消耗两溶液的体积
B.将1mLpH=3的醋酸溶液稀释到100mL,测其pH小于5
C.比较浓度均为0.1mol·L-1盐酸和醋酸溶液的导电能力
D.测定0.1mol·L-1醋酸溶液的PH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过____方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
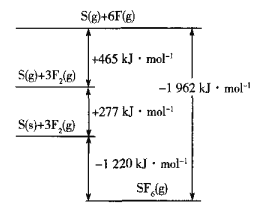
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
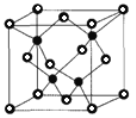
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究铁离子与硫离子的反应,实验操作及现象如表:下列有关说法错误的( )
| 滴入FeCl3溶液立刻有黑色沉淀生成继续滴入FeC13溶液,黑色沉淀增多后又逐渐转化为黄色沉淀 |
| 滴入Na2S溶液立刻生成黑色沉淀,沉淀下沉逐渐转化为黄色。继续滴入Na2S溶液,最后出现黑色的沉淀 |
A.两次实验中,开始产生的黑色沉淀都为Fe2S3
B.两次实验中,产生的黄色沉淀是因为发生了反应Fe2S3+4FeCl3═6FeCl2+3S
C.向稀FeCl3溶液中逐滴加入稀Na2S溶液至过量最后生成的黑色沉淀为FeS
D.在Na2S溶液过量的情况下,黑色沉淀中存在较多的Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是重要的还原剂。以铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3等杂质)为原料制备NaAlH4的一种流程如图:
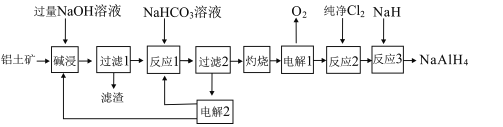
已知:碱浸中SiO2转化成难溶的Na2Al2SixO8
(1)Na2Al2SixO8用氧化物的形式表示为___(x用具体的数值表示)。
(2)过滤1得滤液的主要成分为NaOH和NaAlO2,写出反应1中NaHCO3与NaAlO2反应的离子方程式:___。
(3)电解2生成NaHCO3和NaOH用于循环使用,写出电解2阴极的电极反应式:___。
(4)反应3的化学方程式为___。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为___。
(6)滤渣主要成分有Na2Al2SixO8和Fe2O3,可以采用如图流程进行分离:

①滤渣溶于盐酸所得的固体物质可能为___(填化学式)。
②滤渣溶于盐酸的“酸浸率”与温度关系如图所示,试解释温度过高,“酸浸率”降低的原因___。
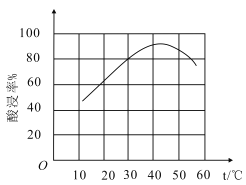
③已知常温下,Ksp[Fe(OH)3]=8.0×10-38,Al3+开始沉淀的pH为4,(溶液中离子的浓度小于1×10-5mol/L为沉淀完全),从滤液中先分离出Fe3+,应调节pH范围为___(lg2≈0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为某学习小组探究用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物的实验装置。
(1)甲同学设计如图所示的实验装置检验气体产物。
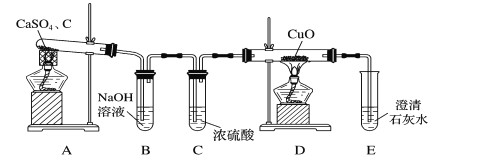
①B装置的作用是___。
②D和E装置能检验装置A的反应产物中有气体__(填化学式),能说明产生有该气体的现象是__。
(2)乙同学根据氧化还原反应原理,提出装置A产生的气体产物中可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。
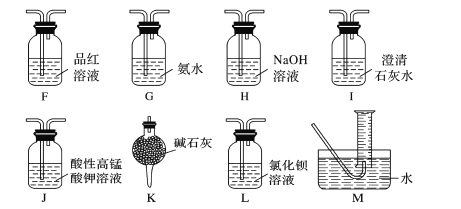
①气流从左至右,仪器连接顺序为A、F、__、M。
②能证明有CO2的现象是__。
③除去SO2的离子方程式为__。
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是_______(填序号);
A 2v(H2)(正)=3v(NH3)(逆)
B 2v(N2)(正)=v(H2)(逆)
C 容器内压强保持不变
D 混合气体的密度保持不变
(2)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
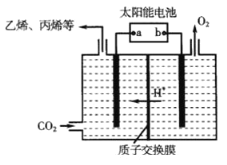
①该工艺中能量转化方式主要有_______。
②电解时,生成乙烯的电极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)作为著名的铁电和压电材料,因其优异电性能和低污染性受到人们重视,也是目前制备无铅压电陶瓷的重要候选材料。某工厂以重晶石(主要含BaSO4)为原料,生产钛酸钡的工艺流程如图:

回答下列问题:
(1)酸浸时将BaCO3研成粉末并适当增大盐酸浓度,是为了___;常温下,TiCl4为液体且极易水解,配制一定浓度的TiCl4溶液的方法是__。
(2)用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K=__(填写计算结果);若不考虑CO32-的水解,要使2.33gBaSO4恰好完全转化为BaCO3,则至少需要浓度为1.0mol·L-1Na2CO3溶液__mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
(3)流程中“滤液"的主要成分为__;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和混合气态产物,试写出反应的化学方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com