
【题目】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(![]() )>c(
)>c(![]() )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+)
【答案】AD
【解析】
A.(NH4)2Fe(SO4)2中亚铁离子及铵根离子都水解,但水解程度较小,根据物料守恒判断;
B.pH=11的氨水浓度大于pH=3的盐酸浓度,二者等体积混合,氨水有剩余,溶液呈碱性,溶液中存在电荷守恒,根据电荷守恒判断;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.二者混合后,溶液中的溶质是等物质的量浓度的NaCl、CH3COOH、CH3COONa,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度。
A.(NH4)2Fe(SO4)2中亚铁离子及铵根离子都水解,但水解程度较小,根据物料守恒得c(![]() )>c(
)>c(![]() )>c(Fe2+)>c(H+),故A正确;
)>c(Fe2+)>c(H+),故A正确;
B.pH=11的氨水浓度大于pH=3的盐酸浓度,二者等体积混合,氨水有剩余,溶液呈碱性,溶液中存在电荷守恒,根据电荷守恒得c(Cl-)< c(![]() ),离子浓度关系为: c(
),离子浓度关系为: c(![]() )>c(Cl-) >c(OH-)>c(H+),故B错误;
)>c(Cl-) >c(OH-)>c(H+),故B错误;
C.在0.1molL1Na2CO3溶液中,Na元素的物质的量是C元素物质的量的2倍,则c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)],故C错误;
)+c(H2CO3)],故C错误;
D.二者混合后,溶液中的溶质是等物质的量浓度的NaCl、CH3COOH、CH3COONa,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,氯离子不水解、醋酸电离程度较小,所以离子浓度大小顺序是c(CH3COO)>c(Cl)>c(CH3COOH)>c(H+),故D正确;
故选AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将0.2 mol AgNO3、0.4 mol Cu(NO3)2和0.6 mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.3 mol Cu,此时,另一极上的气体体积(标准状况)为( )
A. 4.48 L B. 5.6 L C. 6.7 L D. 7.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空
(1)CaCO3(s)加热分解生成CaO(s)和CO2(g),△S____________。(填“>0”、“<0”或“=0”)
(2)已知拆开1 mol H—H键, 1 mol N—H键,1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为___________________________________________________________。
(3)已知:![]() △H=-393.5kJ/mol
△H=-393.5kJ/mol
![]() △H=-571.6kJ/mol
△H=-571.6kJ/mol
![]() △H=-2599 kJ/mol
△H=-2599 kJ/mol
计算298K时由C(s,石墨)和H2(g)生成 1 mol C2H2(g)反应的焓变:![]() ___________________。
___________________。
(4)某研究组设想以如图所示装置用电化学原理生产硫酸。

通入SO2的一极电极反应式:__________________________________
(5)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图转化关系中的m、n、p、q均含氯元素的常见物质,其中p、q为酸,n为单质,下列叙述不正确的是( )
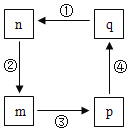
A.n在标况下的密度约为3.17gL-1
B.反应②中物质n与电子转移的物质的量相等
C.p氧化性强于q
D.四步反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下图所示,下列说法不正确的是
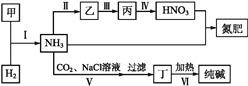
A. 甲、乙、丙三种物质中都含有氮元素
B. 反应Ⅰ、Ⅱ、Ⅲ中含氮元素的反应物都被氧化
C. Ⅴ中发生反应:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
D. Ⅵ利用丁物质受热易分解的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求写出电子式:CO2_________ COCl2_________ NaCN______ N2H![]() _______
_______
(2)元素周期表中“对角线规则”是指处于周期表中对角线位置(左上和右下方)的两元素,其性质具有相似性,例如:Be和Al处于对角线位置。写出Be与氢氧化钠溶液反应的化学方程式:_________________________________。
(3)写出氢,氧,钠,硫四种元素组成的两种酸式盐发生复分解反应的离子方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是合成治疗禽流感和甲型H1N1流感药物——达菲的重要原料。已知莽草酸的结构简式如图所示。下列关于这种有机化合物的说法正确的是( )
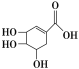
A.莽草酸的分子式为C6H10O5
B.莽草酸能使溴的四氯化碳溶液褪色
C.莽草酸遇FeCl3溶液显紫色
D.1mol莽草酸与足量氢氧化钠反应,最多消耗氢氧化钠4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com