
【题目】(1)按要求写出电子式:CO2_________ COCl2_________ NaCN______ N2H![]() _______
_______
(2)元素周期表中“对角线规则”是指处于周期表中对角线位置(左上和右下方)的两元素,其性质具有相似性,例如:Be和Al处于对角线位置。写出Be与氢氧化钠溶液反应的化学方程式:_________________________________。
(3)写出氢,氧,钠,硫四种元素组成的两种酸式盐发生复分解反应的离子方程式:___________________。
【答案】![]()
![]()
![]()
![]() Be+2OH-═BeO22-+H2↑ H++HSO3-=SO2↑+H2O
Be+2OH-═BeO22-+H2↑ H++HSO3-=SO2↑+H2O
【解析】
(1)先分析是共价化合物还是离子化合物,再分析原子之间形成共用电子对的数目;
(2)Be(OH)2与Al(OH)3的性质相似,故Be(OH)2与NaOH反应生成Na2BeO2与H2O;
(3)由氢,氧,钠,硫四种组成的两种酸式盐能够发生反应,这两种酸式盐应为硫酸的酸式盐和亚硫酸的酸式盐。
(1)CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为![]() ,COCl2分子中含有1个碳氧双键、2个碳氯键,其电子式为
,COCl2分子中含有1个碳氧双键、2个碳氯键,其电子式为![]() ,NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,电子式为
,NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,电子式为![]() ,N2H
,N2H![]() 相当于是N2H4结合了一个氢离子,故其电子式为:
相当于是N2H4结合了一个氢离子,故其电子式为:![]() ;故答案为:
;故答案为:![]() ;
;![]() ;
;![]() ;
;![]() ;
;
(2)Be与Al的性质相似,则Be与NaOH溶液反应的化学方程式为:Be+2NaOH═Na2BeO2+H2↑,改成离子方程式为:Be+2OH-═BeO22-+H2↑,故答案为:Be+2OH-═BeO22-+H2↑;
(3)由氢、氧、钠、硫组成的两种酸式盐能够发生反应,这两种酸式盐应为硫酸的酸式盐和亚硫酸的酸式盐,反应的离子方程式为H++HSO3-=SO2↑+H2O,故答案为:H++HSO3-=SO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法正确的是 ( )
A. 升高温度可降低化学反应的活化能,使化学反应速率提高
B. 在温度、体积都相同的两容器中,分别充入相同物质的量的Br2和Cl2,让它们与等量的氢气发生反应,反应速率相同
C. 0.1 mol·L-1盐酸和0.1 mol·L-1硝酸与相同形状和大小的大理石反应的速率相同
D. 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(![]() )>c(
)>c(![]() )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A.NaOH溶液与![]() 反应,当
反应,当![]() :
:![]() :3时:
:3时:![]()
B.酸性条件下![]() 溶液与KI溶液发生反应生成
溶液与KI溶液发生反应生成![]() :
:![]()
C.![]() 溶液中加入过量的氨水:
溶液中加入过量的氨水:![]()
D.1![]() 的
的![]() 溶液和
溶液和![]()
![]() 的HCl等体积互相均匀混合:
的HCl等体积互相均匀混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 的二元酸
的二元酸![]() 溶液中滴加
溶液中滴加![]() 溶液,溶液中含A元素的粒子的物质的量随NaOH溶液的体积变化如图,y点对应溶液的
溶液,溶液中含A元素的粒子的物质的量随NaOH溶液的体积变化如图,y点对应溶液的![]() 。下列说法中不正确的是
。下列说法中不正确的是 ![]()
![]()
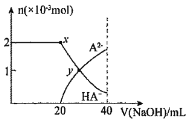
A.二元酸![]() 的电离方程式为:
的电离方程式为:![]()
![]()
B.当溶液中![]() 和NaHA物质的量相等时:
和NaHA物质的量相等时:![]()
C.在x点溶液中离子浓度大小关系:![]()
D.常温下![]() 的电离常数为
的电离常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa的条件下,

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
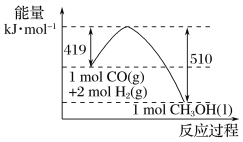
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”)________kJ能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是

A.X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B.X是一种常温下能稳定存在的液态烃
C.X和乙烷类似,都容易发生取代反应
D.充分燃烧等质量的X和甲烷,X消耗氧气较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]()
![]() ,起始加入量
,起始加入量![]() 为
为![]() ,
,![]() 为
为![]() ,HCOOH为
,HCOOH为![]() ,在一定温度下,不同时刻甲酸乙酯的物质的量如下:
,在一定温度下,不同时刻甲酸乙酯的物质的量如下:![]() 注:本题速率单位用
注:本题速率单位用![]() 表示
表示![]()
| 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
|
|
|
|
|
|
|
|
|
|
|
|
|
下列说法不正确的是 ![]()
![]()
A.以表中![]() 为单位,
为单位,![]() 内最大的平均反应速率在
内最大的平均反应速率在![]() 之间
之间
B.前![]() 甲酸乙酯的平均反应速率为
甲酸乙酯的平均反应速率为![]()
C.甲酸乙酯的反应速率先增大后减小的原因是该反应放热
D.开始时若加适量的NaOH,也可以加快甲酸乙酯水解速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com