
【题目】莽草酸是合成治疗禽流感和甲型H1N1流感药物——达菲的重要原料。已知莽草酸的结构简式如图所示。下列关于这种有机化合物的说法正确的是( )
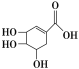
A.莽草酸的分子式为C6H10O5
B.莽草酸能使溴的四氯化碳溶液褪色
C.莽草酸遇FeCl3溶液显紫色
D.1mol莽草酸与足量氢氧化钠反应,最多消耗氢氧化钠4mol
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(![]() )>c(
)>c(![]() )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa的条件下,

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
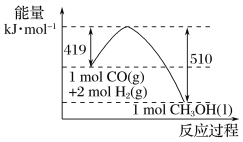
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”)________kJ能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是

A.X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B.X是一种常温下能稳定存在的液态烃
C.X和乙烷类似,都容易发生取代反应
D.充分燃烧等质量的X和甲烷,X消耗氧气较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.核外电子排布相同的微粒化学性质相同
B.将FeCl3溶液加热蒸干,可以制备无水FeCl3
C.浓硝酸保存在棕色玻璃试剂瓶中
D.甲烷中混有乙烯,用高锰酸钾溶液除杂,可以得到纯净的甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H<0。已知1100℃时K=0.263。
Fe(s)+CO2(g) △H<0。已知1100℃时K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值___,平衡常数K值___(增大、减小或不变)
(2)1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态____(“是”或“否”),此时,化学反应速率是υ正__υ逆(大于、小于或等于),其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,相同浓度A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是___,B是___。
(2)写出C与D反应的离子方程式___。
(3)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=___(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为___。
(5)在一定体积的0.005mol·L-1的C溶液中,加入一定体积的0.00125mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]()
![]() ,起始加入量
,起始加入量![]() 为
为![]() ,
,![]() 为
为![]() ,HCOOH为
,HCOOH为![]() ,在一定温度下,不同时刻甲酸乙酯的物质的量如下:
,在一定温度下,不同时刻甲酸乙酯的物质的量如下:![]() 注:本题速率单位用
注:本题速率单位用![]() 表示
表示![]()
| 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
|
|
|
|
|
|
|
|
|
|
|
|
|
下列说法不正确的是 ![]()
![]()
A.以表中![]() 为单位,
为单位,![]() 内最大的平均反应速率在
内最大的平均反应速率在![]() 之间
之间
B.前![]() 甲酸乙酯的平均反应速率为
甲酸乙酯的平均反应速率为![]()
C.甲酸乙酯的反应速率先增大后减小的原因是该反应放热
D.开始时若加适量的NaOH,也可以加快甲酸乙酯水解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 。在
。在![]() 的密闭容器中进行模拟合成实验,将
的密闭容器中进行模拟合成实验,将![]() 和
和![]() 通入容器中,分别在
通入容器中,分别在![]() 和
和![]() 反应,每隔一段时间测得容器中的甲醇的浓度如下:
反应,每隔一段时间测得容器中的甲醇的浓度如下:
| 10 | 20 | 30 | 40 | 50 | 60 |
300 | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
下列说法正确的是 ![]()
![]()
A.![]() 时,开始
时,开始![]() 内
内![]() 的平均反应速率
的平均反应速率![]()
B.反应达到平衡时,两温度下CO和![]() 的转化率之比均为
的转化率之比均为![]()
C.![]() 反应达到平衡时,放出的热量为
反应达到平衡时,放出的热量为![]()
D.![]() 时,若容器的容积压缩到原来的
时,若容器的容积压缩到原来的![]() ,则
,则![]() 增大,
增大,![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com