
【题目】A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,相同浓度A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是___,B是___。
(2)写出C与D反应的离子方程式___。
(3)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=___(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为___。
(5)在一定体积的0.005mol·L-1的C溶液中,加入一定体积的0.00125mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是___。
【答案】CH3COONa NH4Cl Ba2++SO42-=BaSO4↓ 10a-14 c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+) 1∶4
【解析】
有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复)。
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠。据此分析解答。
(1)通过以上分析知,A是CH3COONa、B是NH4Cl,故答案为:CH3COONa;NH4Cl;
(2)C是氢氧化钡、D是硫酸钠,钡离子和硫酸根离子反应生成硫酸钡沉淀,离子方程式为Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓;
(3)B是NH4Cl,0.1mol·L-1B溶液的pH=a,根据溶液中电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),根据溶液中物料守恒得 c(NH3·H2O)+c(NH4+)=c(Cl-),将两个等式相减得c(H+)-c(NH3H2O)=c(OH-)=10 a-14,故答案为:10 a-14;
(4)B是NH4Cl,C是氢氧化钡,根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,溶液中氢氧根离子浓度最大,钡离子和氯离子浓度相等,氨水是弱碱部分电离导致氯离子浓度大于铵根离子浓度,溶液呈碱性,氢离子浓度最小,所以溶液中离子浓度大小顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+),故答案为:c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+);
(5)C是氢氧化钡,在一定体积的0.005mol·L-1的氢氧化钡溶液中,加入一定体积的0.00125mol·L-1的盐酸时,混合溶液的pH=11,溶液显碱性,则碱过量,过量c(OH-)=0.001mol/L,设氢氧化钡溶液的体积为x,盐酸的体积为y,由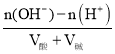 =0.001可知,
=0.001可知,![]() =0.001,解得x∶y=1∶4,故答案为:1∶4。
=0.001,解得x∶y=1∶4,故答案为:1∶4。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】某溶液中,只可能含有下列离子中的几种:
阳离子 | K+、Mg2、Fe3+、Al3+ |
阴离子 |
|
现每次取100.00mL溶液进行实验:①第一份加入硝酸银溶液有沉淀产生;②第二份加入足量氯化钡溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。下列说法错误的是( )
A.c(![]() )=0.2 mol/LB.c(K+)一定为0.6mol/L
)=0.2 mol/LB.c(K+)一定为0.6mol/L
C.氯离子可能存在D.一定有![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为___、___。
(2)XZ2与YZ2分子的立体构型分别是__和__,相同条件下两者在水中的溶解度较大的是___(写分子式),理由是__。
(3)Q的元素符号是__,它属于第__周期,它的核外电子排布式为__,在形成化合物时它的最高化合价为___。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题:![]() 为了配制模拟尾气,甲组同学用下图所示装置分别制备NO、乙烯及CO三袋气体。
为了配制模拟尾气,甲组同学用下图所示装置分别制备NO、乙烯及CO三袋气体。
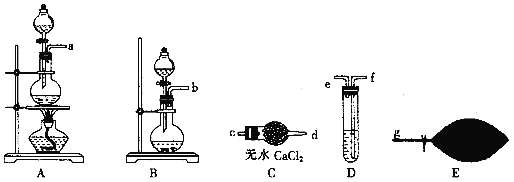
![]() 用装置A制取NO,分液漏斗中盛放的是________
用装置A制取NO,分液漏斗中盛放的是________![]() 填试剂名称
填试剂名称![]() 。
。
![]() 用
用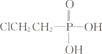
![]() 乙烯利
乙烯利![]() 与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为____
与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为____![]() 磷转化为
磷转化为![]() 。
。
![]() 用
用![]() 与浓硫酸制取
与浓硫酸制取![]() 化学方程式为
化学方程式为![]() 并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为____
并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为____![]() 气流从左至右
气流从左至右![]() ,其中装置D中盛放的药品是_______。
,其中装置D中盛放的药品是_______。
![]() 乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气
乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气![]() 、CO、
、CO、![]() 及空气
及空气![]() ,按如图所示装置进行尾气转化并检验。
,按如图所示装置进行尾气转化并检验。

![]() 为检验催化反应后的气体中是否有
为检验催化反应后的气体中是否有![]() 生成和乙烯的残留,G、H中盛放的试剂依次是_____、____
生成和乙烯的残留,G、H中盛放的试剂依次是_____、____![]() 填标号
填标号![]() 。
。
![]() 溶液
溶液 ![]() 酸性
酸性![]() 溶液
溶液 ![]() 澄清石灰水
澄清石灰水 ![]() 溶液
溶液
![]() 通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是_____;写出其中CO与NO完全转化为无害气体的化学方程式:____________
通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是_____;写出其中CO与NO完全转化为无害气体的化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下述操作步骤:①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量![]() 生成
生成![]() 沉淀 ⑤加盐酸生成
沉淀 ⑤加盐酸生成![]() 沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
A.②③④③B.②③⑤③C.①③④③D.②⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为探究铁与浓硫酸![]() 足量
足量![]() 的反应,并验证
的反应,并验证![]() 的性质,设计如图所示装置进行实验,下列说法不正确的是()
的性质,设计如图所示装置进行实验,下列说法不正确的是()
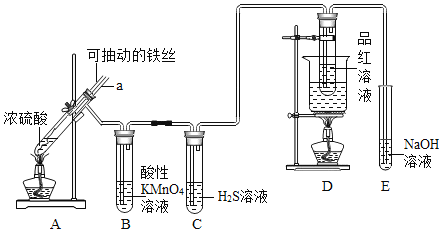
A.装置B中酸性![]() 溶液逐渐褪色,体现了二氧化硫的还原性
溶液逐渐褪色,体现了二氧化硫的还原性
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的![]()
C.装置D中品红溶液褪色可以验证![]() 的漂白性
的漂白性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟利昂在光照下会产生氯原子自由基,对臭氧的分解有催化作用,该反应的能量变化如图所示,则下列说法不正确的是( )
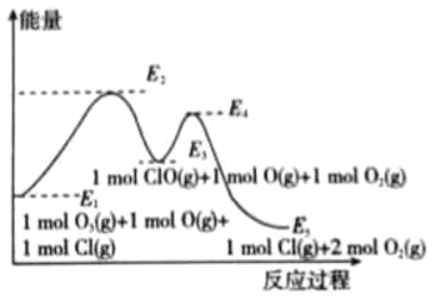
A.催化剂不改变总反应的热效应△H
B.催化剂催化反应过程为:O3(g)+Cl(g)=ClO(g)+O2(g),ClO(g)+O(g)=Cl(g)+O2(g)
C.总反应:O3(g)+O(g)═2O2(g)△H=(E1﹣E5)
D.各1 mol反应物O3(g)与Cl(g)的总能量低于各1mol生成物ClO(g)与O2(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用金属钠和CO2在一定条件下制得了金刚石:
(1)配平上述反应的化学方程式: ___ Na + _____CO2![]() _____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
_____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
(2)CO2的电子式为:_________________,Na原子核外电子有_______个能级。
(3)已知:
常压下 | 钠 | Na2CO3 | 金刚石 | 石墨 |
熔点(℃) | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
若反应在常压、890℃下进行,写出该反应的平衡常数表达式______________________。若3v正(Na)=4v逆(CO2),则________(选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(4)副产物Na2CO3溶于水后溶液呈碱性,请结合平衡移动的原理,用文字描述所得溶液呈碱性的原因:______________________________________________________________________________________。若在10升容器中,反应进行了5min, 金刚石的质量增加了6g,则5min里CO2的平均反应速率 为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
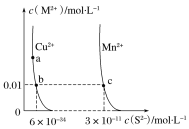
A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10-23:1
D.a点对应的Ksp大于b点对应的Ksp
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com