
����Ŀ���й���ѧ���ý����ƺ�CO2��һ���������Ƶ��˽��ʯ��
��1����ƽ������Ӧ�Ļ�ѧ����ʽ�� ___ Na + _____CO2![]() _____Na2CO3 + _____C(���ʯ)������Ӧ��������0.15mol CO2��Ӧ�������ת�Ƶ���ĿΪ��____________��
_____Na2CO3 + _____C(���ʯ)������Ӧ��������0.15mol CO2��Ӧ�������ת�Ƶ���ĿΪ��____________��
��2��CO2�ĵ���ʽΪ��_________________��Naԭ�Ӻ��������_______���ܼ���
��3����֪��
��ѹ�� | �� | Na2CO3 | ���ʯ | ʯī |
�۵㣨���� | 97.8 | 851 | 3550 | 3850 |
�е㣨���� | 882.9 | 1850���ֽ����CO2�� | ---- | 4250 |
����Ӧ�ڳ�ѹ��890���½��У�д���÷�Ӧ��ƽ�ⳣ������ʽ______________________����3v��(Na)=4v��(CO2)����________��ѡ����ţ���
a����Ӧ�϶��ﵽƽ�� b����Ӧ���ܴﵽƽ�� c����Ӧ�϶�δ��ƽ��
��4��������Na2CO3����ˮ����Һ�ʼ��ԣ�����ƽ���ƶ���ԭ��������������������Һ�ʼ��Ե�ԭ��______________________________________________________________________________________������10�������У���Ӧ������5min, ���ʯ������������6g����5min��CO2��ƽ����Ӧ���� Ϊ______________��
���𰸡�4 3 2 1 0.2NA ![]() 4 K=
4 K=![]() a ����̼����������ʣ�Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȡ� 0.03 mol/(L��min)
a ����̼����������ʣ�Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȡ� 0.03 mol/(L��min)
��������
��1�����ݵ����غ��������������ת�Ƶ�����Ŀ��
��2��������̼�ĵ���ʽΪ![]() ��Naԭ�Ӻ�������Ų�ʽΪ1s22s22p63s1��
��Naԭ�Ӻ�������Ų�ʽΪ1s22s22p63s1��
��3������һЩ���ʵ��۷е����ݣ��ڳ�ѹ��890��ʱNa��CO2������̬��Na2CO3��C��������̬����ɵø÷�Ӧ��ƽ�ⳣ������ʽ������һ��һ�棬����֮�ȵ���ϵ���ȣ���Ӧ�϶��ﵽƽ�⣻
��4��Na2CO3����ˮ����Һ�ʼ�������Ϊ̼�������ˮ�⣻CO2��ƽ����Ӧ����=![]() ��
��
��1����Ӧ����Ԫ�ش�0�����ߵ�+1�ۣ�����1�ۣ�̼Ԫ�ش�+4�۽��͵�0�ۣ�����4�ۣ���˵������뵥��̼�ļ�����֮��Ϊ4:1���ٸ���Ԫ���غ���ƽ�������ʵļ���������ƽ��ķ���ʽΪ4Na+3CO22Na2CO3+C����3mol CO2��Ӧʱ��ת��4mol���ӣ�����0.15mol CO2��Ӧʱ��ת�Ƶ���0.2mol���ʴ�Ϊ��4��3��2��1��0.2NA��
��2��������̼�ĽṹʽΪO=C=O��C��O֮��������Ե��Ӷԣ��ʵ���ʽΪ![]() ��Naԭ�Ӻ�������Ų�ʽΪ1s22s22p63s1����4���ܼ����ʴ�Ϊ
��Naԭ�Ӻ�������Ų�ʽΪ1s22s22p63s1����4���ܼ����ʴ�Ϊ![]() ��4��
��4��
��3�����ݱ���һЩ���ʵ��۷е����ݣ���֪�ڳ�ѹ��890��ʱNa��CO2������̬��Na2CO3��C��������̬����÷�Ӧ��ƽ�ⳣ������ʽ ![]() ����3v����Na��=4v����CO2��������һ��һ�棬����֮�ȵ���ϵ���ȣ���Ӧ�϶��ﵽƽ�⣬�ʴ�Ϊ��K=
����3v����Na��=4v����CO2��������һ��һ�棬����֮�ȵ���ϵ���ȣ���Ӧ�϶��ﵽƽ�⣬�ʴ�Ϊ��K=![]() ��a��
��a��
��4��Na2CO3����ˮ��̼�������ˮ�⣬Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȣ�������Ӧ��10L�ܱ���������ѹ�½��У�5min�ڣ���ý��ʯ������������6g����Ӧ�Ķ�����̼���ʵ�����ϻ�ѧ����ʽ����õ���4Na+3CO22Na2CO3+C�����ʯ�����������ʵ���1.5mol����Ӧ����v��CO2��=![]() =
=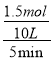 =0.03mol/��Lmin�����ʴ�Ϊ������̼����������ʣ�Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȣ� 0.03 mol/(L��min)��
=0.03mol/��Lmin�����ʴ�Ϊ������̼����������ʣ�Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȣ� 0.03 mol/(L��min)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᰱ��������ٴ���Ҫ�������ư�֢��ҩ�F�Ǻϳ����ᰱ����ǵ������м���֮һ����ϳ�·�����£�
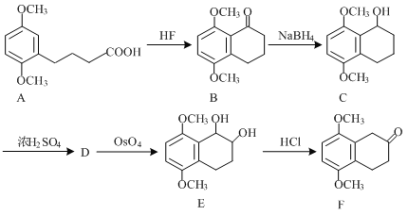
(1)������A�к�����������____________________��д���ƣ���
(2)������D�ķ���ʽΪC12H14O2����д��D�Ľṹ��ʽ��_________��
(3)B��C�ķ�Ӧ������________________��
(4)д��ͬʱ��������������B��һ��ͬ���칹��Ľṹ��ʽ��_________��
���ܷ���������Ӧ��������FeCl3��Һ������ɫ��Ӧ��
�����к���4�ֲ�ͬ��ѧ�������⡣
(5)��д����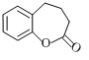 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·�ߣ����Լ���ѡ�����ϳ�·����������������ɡ�____________��
�ĺϳ�·�ߣ����Լ���ѡ�����ϳ�·����������������ɡ�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����ǿ����ʣ�������ˮ�е���ʱ�ɲ�����������(ÿ������ֻ��һ���������һ����ظ�)��
������ | Na����Ba2����NH4+ |
������ | CH3COO����Cl����OH����SO42- |
��֪����A��C��Һ��pH������7����ͬŨ��A��B����Һ��ˮ�ĵ���̶���ͬ����C��Һ��D��Һ����ʱֻ���ɰ�ɫ������B��Һ��C��Һ����ʱֻ���ɴ̼�����ζ�����壬A��Һ��D��Һ���ʱ����������
��1��A��___��B��___��
��2��д��C��D��Ӧ�����ӷ���ʽ___��
��3��25��ʱ��0.1mol��L��1B��Һ��pH��a����B��Һ��c(H��)��c(NH3��H2O)��___(�ú���a�Ĺ�ϵʽ��ʾ)��
��4����������������ʵ���Ũ�ȵ�B��Һ��C��Һ��ϣ���Ӧ����Һ�и�������Ũ���ɴ�С��˳��Ϊ___��
��5����һ�������0.005mol��L��1��C��Һ�У�����һ�������0.00125mol��L��1������ʱ�������Һ��pH��11������Ӧ����Һ���������C��Һ����������֮�ͣ���C��Һ��������������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ͼ��Ӧ���ǣ� ��
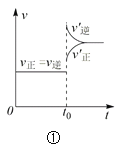
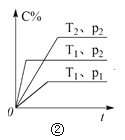
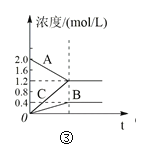
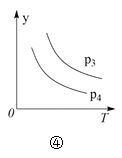
A.���ڴﵽƽ��״̬��N2(g) + 3H2(g) 2NH3(g)��ͼ�ٱ�ʾ��t0ʱ�̳�����һ������NH3��ƽ�������ƶ�
B.��ͼ�ڿ�֪��p2 > p1��T1 > T2���㷴Ӧ��2A(g) + B(g) 2C(g) ��H < 0
C.ͼ�۱�ʾ�ķ�Ӧ����ʽΪ2A = B + 3C
D.���ڷ�Ӧ2X(g) + 3Y(g) 2Z(g) ��H < 0��ͼ��y����Ա�ʾY�İٷֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵������ȷ����( )
A.1mol CH3COONa������CH3COOH����ˮ���õ�������Һ�У�CH3COO����ĿΪNA
B.��״���£�2.24 L�״���C��H������ĿΪ0.3NA
C.4.6gNa��100mL1.0mol/L��������Һ��Ӧ��ת�Ƶ�����ĿΪ0.2NA
D.NA��D2 16O�������10NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Ksp(BaSO4)=1��10��10��Ksp(BaCO3)=2.6��10��9�����¶��£�����˵������ȷ������ ��
A. ͬŨ�ȵ�Na2SO4��Na2CO3�����Һ�еμ�BaCl2��Һ��BaSO4������
B. BaCO3������Һ�м���������������ˮ��c(Ba2+)����
C. BaSO4��BaCO3���������Һ�У� 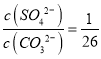
D. BaSO4����Һ�м���Na2CO3Ũ��Һ��BaSO4������ת��ΪBaCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
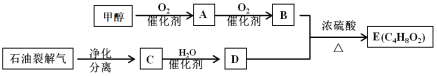
����Ŀ���Լ״���ʯ���ѽ���Ϊԭ�Ͽ��Ƶ�E����֪E�����־����з�����ζ���л�����ɵĻ����������ת����ϵ���£�
��ش�
��1��д��C�й����ŵĻ�ѧʽ_______________��A�Ľṹ��ʽ��___________________��
��2��C��D�Ļ�ѧ����ʽ��_______________________________ ��_____________________________��
��3��������ͬ�����ŵ��л���ͨ���������ƵĻ�ѧ���ʣ���˿���Ԥ��E������___________��������ƵĻ�ѧ���ʡ���ȥ������B��D��E������е�B��D���ɲ��õķ����ǣ�__________________________________________________________________________��
��4��д��һ����![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ� ![]() �ĺϳ�·�ߡ����������ýṹ��ʽ��ʾ���ɣ��ϳ�·�߳��õı�ʾ��ʽΪ��__________________________________________________________
�ĺϳ�·�ߡ����������ýṹ��ʽ��ʾ���ɣ��ϳ�·�߳��õı�ʾ��ʽΪ��__________________________________________________________![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���E(C3H3Cl3)��һ�ֲ�ǰ���ݼ���ǰ�壬��ϳ�·����ͼ����֪D�ڷ�Ӧ���������ɵ�E����ṹֻ��һ�ֿ��ܣ�E��������3�ֲ�ͬ���͵���ԭ�ӣ������ǿռ��칹�����Իش��������⣺
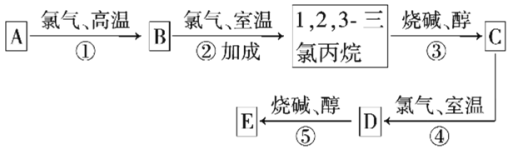
��1����������е���Ϣ�Ʋ��л���D��������___��
��2��д�����з�Ӧ�����ͣ���Ӧ����__����Ӧ����__��
��3���л���E��ͬ��ͬ���칹�干��___��(������E�������ǿռ��칹)��
��4����д����Ӧ�۵Ļ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ��W��X��Y��Z��ԭ��������������W��X�ļ����Ӿ�����ͬ���Ӳ�ṹ��X��ԭ�Ӱ뾶�Ƕ���������Ԫ��ԭ�������ģ�W��Yͬ�壬Z��X�γɵ����ӻ������ˮ��Һ�����ԡ�����˵����ȷ���ǣ� ��
A.�����Ӱ뾶��![]()
B.W��X�γɵĻ���������ˮ����Һ�ʼ���
C.��̬�⻯������ȶ��ԣ�![]()
D.����������ˮ��������ԣ�![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com