
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.1mol CH3COONa与少量CH3COOH溶于水所得的中性溶液中,CH3COO﹣数目为NA
B.标准状况下,2.24 L甲醇中C﹣H键的数目为0.3NA
C.4.6gNa与100mL1.0mol/L的盐酸溶液反应,转移电子数目为0.2NA
D.NA个D2 16O分子中含有10NA个中子
【答案】B
【解析】
A.溶液中电荷守恒式为c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣),该溶液显中性,则c(H+)=c(OH﹣),故c(Na+)=c(CH3COO﹣),n(Na+)=n(CH3COO﹣)=1 mol,即CH3COO﹣数目为NA,故A正确;
B.标准状况下,2.24 L甲醇不是气体,不能计算物质的量,故B错误;
C.依据n=![]() 计算物质的量=
计算物质的量=![]() =0.2mol,钠在盐酸溶液中全部反应,Na由0价变为+1价,1mol钠转移1mol电子,4.6gNa为0.2mol,电子转移数目为0.2NA,故C正确;
=0.2mol,钠在盐酸溶液中全部反应,Na由0价变为+1价,1mol钠转移1mol电子,4.6gNa为0.2mol,电子转移数目为0.2NA,故C正确;
D.NA个D216O分子物质的量为1mol,1molD216O 分子中中子数为:[(2﹣1)×2+16﹣8]×NA=10NA,故D正确;
答案选B。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】化合物M具有广谱抗菌活性,合成M的反应可表示如下,下列说法正确的是
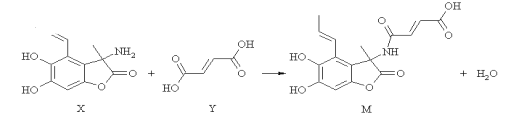
A.X分子中有2个手性碳原子
B.Y分子中所有原子可能在同一平面内
C.可用FeCl3溶液或NaHCO3溶液鉴别X和Y
D.在NaOH溶液中,1 mol M最多可与4 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下述操作步骤:①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量![]() 生成
生成![]() 沉淀 ⑤加盐酸生成
沉淀 ⑤加盐酸生成![]() 沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
A.②③④③B.②③⑤③C.①③④③D.②⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟利昂在光照下会产生氯原子自由基,对臭氧的分解有催化作用,该反应的能量变化如图所示,则下列说法不正确的是( )
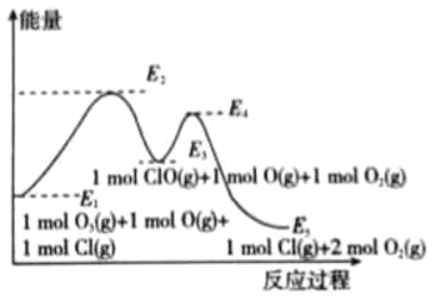
A.催化剂不改变总反应的热效应△H
B.催化剂催化反应过程为:O3(g)+Cl(g)=ClO(g)+O2(g),ClO(g)+O(g)=Cl(g)+O2(g)
C.总反应:O3(g)+O(g)═2O2(g)△H=(E1﹣E5)
D.各1 mol反应物O3(g)与Cl(g)的总能量低于各1mol生成物ClO(g)与O2(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体。
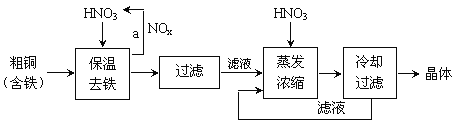
下列说法错误的是
A.步骤a中还需要加入适量的氧气和水
B.保温去铁后过滤,铁元素主要以+2价的沉淀形式被过滤出去
C.蒸发浓缩的过程中加入适当的硝酸,目的是抑制硝酸铜的水解
D.硝酸铜溶液中离子浓度大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用金属钠和CO2在一定条件下制得了金刚石:
(1)配平上述反应的化学方程式: ___ Na + _____CO2![]() _____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
_____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
(2)CO2的电子式为:_________________,Na原子核外电子有_______个能级。
(3)已知:
常压下 | 钠 | Na2CO3 | 金刚石 | 石墨 |
熔点(℃) | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
若反应在常压、890℃下进行,写出该反应的平衡常数表达式______________________。若3v正(Na)=4v逆(CO2),则________(选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(4)副产物Na2CO3溶于水后溶液呈碱性,请结合平衡移动的原理,用文字描述所得溶液呈碱性的原因:______________________________________________________________________________________。若在10升容器中,反应进行了5min, 金刚石的质量增加了6g,则5min里CO2的平均反应速率 为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)有像食盐一样的咸味,被称为工业盐。已知:亚硝酸是弱酸,且NO+NO2 +2NaOH=2NaNO2+H2O。某同学据此认为NaNO2可与硫酸反应,且有NO和NO2生成,并欲用下图所示仪器(夹持装置已省略)及药品,验证自己的假设。已知沸点:NO2为21℃,NO为-151℃

(1)上述仪器的连接顺序为:A→____→_____→_____→B。
(2)反应前,先打开弹簧夹,通入一段时间氮气,其目的是____________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生了红棕色气体,
① 依据___________________现象,可确认产物中有NO
② 装置E的作用是_________________。
(4)如果没有装置C,对实验结论的影响是____________________。
(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为_______________。
(6)己知:2NaNO2+4HI=2NaI+I2+2NO+2H2O,根据这一反应,可以用试剂和生活中的常见物质鉴别亚硝酸钠和食盐,进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾溶液 C.淀粉 D.白糖 E. 食醋 F.白酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)计算调控值:
室温下,当溶液中c(Mg2+)=c(Cu2+)=0.1mol·L-1时,Mg2+、Cu2+开始沉淀至沉淀完全的pH范围分别为__。已知:Ksp[Mg(OH)2]=10-9、Ksp[Cu(OH)2]=10-15,当c(Mg2+)≤1×10-5mol·L-1时视为沉淀完全。
(2)选择调控值
铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下:
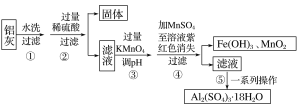
已知步骤③中所得溶液生成氢氧化物沉淀的pH如表所示:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时的pH | 3.4 | 6.3 | 1.5 |
完全沉淀时的pH | 4.7 | 8.3 | 2.8 |
在该浓度下除去铁的化合物,调节pH的最大范围为___。
(3)如何调控
接问题(2),步骤③中调pH时最佳试剂为___。
(4)突破应用
为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。
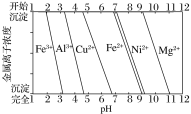
结合题图信息推断该合金中除铜外一定含有__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com