
【题目】某溶液中,只可能含有下列离子中的几种:
阳离子 | K+、Mg2、Fe3+、Al3+ |
阴离子 |
|
现每次取100.00mL溶液进行实验:①第一份加入硝酸银溶液有沉淀产生;②第二份加入足量氯化钡溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。下列说法错误的是( )
A.c(![]() )=0.2 mol/LB.c(K+)一定为0.6mol/L
)=0.2 mol/LB.c(K+)一定为0.6mol/L
C.氯离子可能存在D.一定有![]() 和
和![]()
【答案】B
【解析】
①第一份加入硝酸银溶液有沉淀产生,阴离子中Cl-,CO32-,SO42-;都可能生成沉淀;
②第二份加入足量氯化钡溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g.说明沉淀是碳酸钡沉淀和硫酸钡沉淀,原溶液中一定含有CO32-,SO42-;根据离子共存判断,Mg2、Fe3+、Al3+不能存在;溶液电荷守恒,有阴离子必须有阳离子,所以一定含K+离子;综上所述溶液中一定含有K+,CO32-,SO42-;Cl-可能存在;据此分析解答。
A、依据题意生成碳酸钡沉淀质量=6.27g-2.33g=3.94g,物质的量=![]() =0.02mol,CO32-离子浓度=
=0.02mol,CO32-离子浓度=![]() =0.2mol/L,故A正确;
=0.2mol/L,故A正确;
B、依据钾离子和碳酸根离子和硫酸根离子的电荷守恒计算,由于溶液中Cl-的存在不一定,所以钾离子的浓度不一定是0.6mol/L,故B错误;
C、依据分析判断,氯离子可能存在,故C正确;
D、依据生成沉淀溶液盐酸质量部分减小证明一定含有CO32-,SO42-;故D正确;
故选B。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72—还原为Cr3+。该反应的离子反应方程式为___________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施之一是__________________________ 。
②“水浸”要获得浸出液的操作是_________________________________。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为___。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是 _______。
(3)已知 Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数 Ksp=_______________。
(4)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() + H2O)。
+ H2O)。
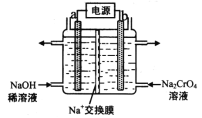
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为_________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 _______________mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图实验装置进行相应实验.装置正确且能达到实验目的是()
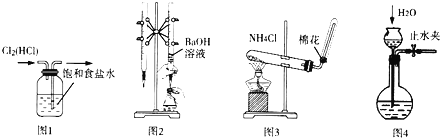
A.用图l所示装置除去![]() 中的HCl杂质
中的HCl杂质
B.用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度
C.用图3所示装置实验室制取![]()
D.用图4所小装置检查装置气密性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的制备装置、制备时使用的原料与收集方法均正确的是( )
序号 | 物质 | 制备装置 | 制备时使用的原料 | 收集方法 | 序号 | 物质 | 制备装置 | 制备时使用的原料 | 收集方法 |
A |
|
|
| 排水法 | B | NO |
| 浓硝酸和金属铜 | 排空气法 |
C |
|
| 浓氨水和氢氧化钠固体 | 排空气法 | D |
|
| 乙醇和 | 排水法 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作,说法正确的是
A. 配制一定物质的量浓度溶液时,容量瓶中有少量的水会导致溶液浓度偏低
B. 用盐酸标准溶液滴定未知浓度氨水,选用酚酞做指示剂的结果比甲基橙更准确
C. 测定硫酸铜晶体中结晶水含量时,加热后的坩埚应直接放置在石棉网上冷却
D. 测定中和热时,应迅速将酸、碱稀溶液在有保温措施的容器内混合、搅拌,记录最高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1 L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
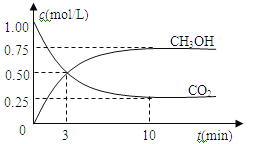
A.进行到3分钟时,正反应速率和逆反应速率相等
B.10分钟后容器中各物质浓度不再改变
C.达到平衡后,升高温度,正反应速率增大、逆反应速率减小
D.3min前v正>v逆,3min后v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氨柔比星是临床主要用于治疗癌症的药物。F是合成盐酸氨柔比星的三种中间体之一,其合成路线如下:
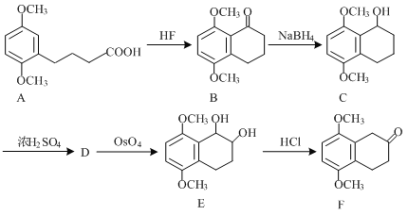
(1)化合物A中含氧官能团有____________________(写名称)。
(2)化合物D的分子式为C12H14O2,请写出D的结构简式:_________。
(3)B→C的反应类型是________________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:_________。
Ⅰ.能发生银镜反应,且能与FeCl3溶液发生显色反应;
Ⅱ.分子中含有4种不同化学环境的氢。
(5)请写出以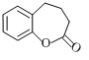 为原料制备
为原料制备![]() 的合成路线(无机试剂任选)。合成路线流程例见本题题干。____________。
的合成路线(无机试剂任选)。合成路线流程例见本题题干。____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,相同浓度A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是___,B是___。
(2)写出C与D反应的离子方程式___。
(3)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=___(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为___。
(5)在一定体积的0.005mol·L-1的C溶液中,加入一定体积的0.00125mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com