
����Ŀ��X��Y��Z��Q��E����Ԫ���У�Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�Yԭ�Ӻ����L���������K���������Z�ǵؿ��ں���(��������)��ߵ�Ԫ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�E��Ԫ�����ڱ��ĸ�Ԫ���е縺�������ش��������⣺
��1��X��Y��Ԫ�ط�������Ϊ___��___��
��2��XZ2��YZ2���ӵ����幹�ͷֱ���__��__����ͬ������������ˮ�е��ܽ�Ƚϴ����___(д����ʽ)��������__��
��3��Q��Ԫ�ط�����__�������ڵ�__���ڣ����ĺ�������Ų�ʽΪ__�����γɻ�����ʱ��������ϼ�Ϊ___��
��4���������ʾʽд��E���⻯����Һ�д��ڵ����������__��
���𰸡�S C V�� ֱ���� SO2 SO2Ϊ���Է��� Cr �� 1s22s22p63s23p63d54s1 +6 F-H��F��O-H��F��O-H��O��F-H...O
��������
Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ���X�ĺ�������Ų�ʽΪ1s22s22p63s23p4��XΪSԪ�أ�Yԭ�Ӻ����L���������K�����������Y��ԭ������Ϊ6��YΪCԪ�أ�Z�ǵؿ��ں���(��������)��ߵ�Ԫ�أ���ZΪOԪ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ���Q�ĺ˵����Ϊ24��QΪCrԪ�أ�E��Ԫ�����ڱ��ĸ�Ԫ���е縺�������EΪFԪ�ء�
��1�����Ϸ�����X��Y��Ԫ�ط�������ΪS��C��
��2��XZ2��YZ2���ӷֱ�ΪSO2��CO2��SO2��S�ļ۵��Ӷ���Ϊ![]() ������Sԭ�Ӱ�sp2��ʽ�ӻ���S��O�γ�2���Ҽ�����һ���µ��Ӷԣ�ΪV�ͣ�CO2�У�C�ļ۲���Ӷ���Ϊ
������Sԭ�Ӱ�sp2��ʽ�ӻ���S��O�γ�2���Ҽ�����һ���µ��Ӷԣ�ΪV�ͣ�CO2�У�C�ļ۲���Ӷ���Ϊ![]() ������Cԭ�Ӱ�sp��ʽ�ӻ���C��O�γ�2���Ҽ���û�йµ��Ӷԣ�Ϊֱ���Σ�SO2�Ǽ��Է��ӣ�H2O�Ǽ��Է��ӣ���CO2�ǷǼ��Է��ӣ������������ܣ�SO2��ͬ������ˮ�е��ܽ�Ƚϴ�
������Cԭ�Ӱ�sp��ʽ�ӻ���C��O�γ�2���Ҽ���û�йµ��Ӷԣ�Ϊֱ���Σ�SO2�Ǽ��Է��ӣ�H2O�Ǽ��Է��ӣ���CO2�ǷǼ��Է��ӣ������������ܣ�SO2��ͬ������ˮ�е��ܽ�Ƚϴ�
��3�����Ϸ�����Q��Ԫ�ط�����Cr�������ڵ������ڣ����������Ϊ24�����������Ų�ʽΪ1s22s22p63s23p63d54s1������������Ϊ6�������γɻ�����ʱ��������ϼ�Ϊ+6�ۡ�
��4��HF��ˮ��Һ�У�F�ĵ縺�Խϴ�����һ�����ӵ�HF��ˮ�����е�H�γ�������ɱ�ʾΪF-H��F����ԭ�Ӻ�ˮ�����е���ԭ���γ�������ɱ�ʾΪO-H��F����ԭ����HF�����е���ԭ���γ�������ɱ�ʾΪF-H...O����ԭ�Ӻ���һ��ˮ�����е���ԭ�����γ�������ɱ�ʾΪO-H��O��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʵ��װ�ý�����Ӧʵ�飮װ����ȷ���ܴﵽʵ��Ŀ���ǣ���
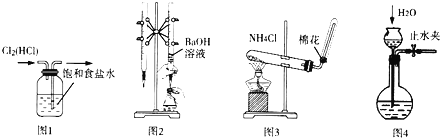
A.��ͼl��ʾװ�ó�ȥ![]() �е�HCl����
�е�HCl����
B.��ͼ2��ʾװ���ñ�Ũ�ȵ�����������Һ�ⶨ�����Ũ��
C.��ͼ3��ʾװ��ʵ������ȡ![]()
D.��ͼ4��Сװ�ü��װ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�������������ȷ����
A. ��ͬһ��Ͳ�Ⱥ��ȡ80 mL������20 mLˮ����������ȫ�ܽ⣬��Һ��Ϊ����ɫ
B. �ڱ������м��������������ټ���3 mLŨ���ᣬ���裬��������ɫ���ɫ
C. ���������ˮ��Һ�еμ��Ȼ�����Һ���ٵμ�˫��ˮ��������ɫ����
D. ����ȼ���þ���������������̼�ļ���ƿ��þ������ȼ�գ��а�ɫ����ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᰱ��������ٴ���Ҫ�������ư�֢��ҩ�F�Ǻϳ����ᰱ����ǵ������м���֮һ����ϳ�·�����£�
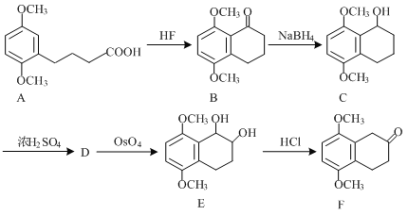
(1)������A�к�����������____________________��д���ƣ���
(2)������D�ķ���ʽΪC12H14O2����д��D�Ľṹ��ʽ��_________��
(3)B��C�ķ�Ӧ������________________��
(4)д��ͬʱ��������������B��һ��ͬ���칹��Ľṹ��ʽ��_________��
���ܷ���������Ӧ��������FeCl3��Һ������ɫ��Ӧ��
�����к���4�ֲ�ͬ��ѧ�������⡣
(5)��д����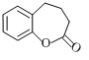 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·�ߣ����Լ���ѡ�����ϳ�·����������������ɡ�____________��
�ĺϳ�·�ߣ����Լ���ѡ�����ϳ�·����������������ɡ�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����������վ������ʾ��������![]() ��
��![]() Ϊ������������Ӱ�������������������Ⱦ�����Ҫ��ԴΪȼú��������β���ȡ���ˣ���
Ϊ������������Ӱ�������������������Ⱦ�����Ҫ��ԴΪȼú��������β���ȡ���ˣ���![]() ��
��![]() ��
��![]() �Ƚ����о�������Ҫ���塣��ش��������⣺
�Ƚ����о�������Ҫ���塣��ش��������⣺
(1)��![]() ����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���� |
|
|
|
|
|
|
Ũ�� |
|
|
|
|
|
|
���ݱ������ݼ���![]() ����������pH =___________��
����������pH =___________��
(2)��������������ʱ������![]() ��
��![]() ��Ӧ����β���п�������ʱ��
��Ӧ����β���п�������ʱ��![]() �ڴ�ת�����б���ԭ��
�ڴ�ת�����б���ԭ��![]() �ų���д��NO��CO��ԭ�Ļ�ѧ����ʽ________��
�ų���д��NO��CO��ԭ�Ļ�ѧ����ʽ________��
(3)��ѭ�����ղ���������![]() ���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�
���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�

�������ӷ���ʽ��ʾ��Ӧ���з����ķ�Ӧ_______��
���û�ѧƽ���ƶ���ԭ����������HI�ֽⷴӦ��ʹ��Ĥ��Ӧ�������![]() ��Ŀ����_______��
��Ŀ����_______��
(4)��ͼ����![]() �ѳ�������NO��ԭ����
�ѳ�������NO��ԭ����
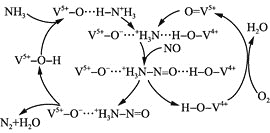
�ٸ�����ԭ���У�NO����ת��Ϊ ________![]() �ѧʽ
�ѧʽ![]() ��H2O��
��H2O��
�ڵ�����![]() ��
��![]() ʱ����ȥ��NO�ڱ�״���µ����Ϊ____L��
ʱ����ȥ��NO�ڱ�״���µ����Ϊ____L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п�̳�(��Ҫ�ɷ�Ϊ ZnO�������� CuO �� FeO)Ϊԭ�ϣ���ȡ�Ȼ�п����(ZnCl2xH2O) �Ĺ����������£�
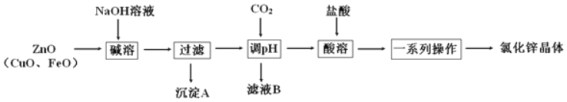 ��֪��Zn���������������Al����������������ƣ�pH��11ʱZn(OH)2������NaOH��Һ����[Zn(OH)4]2����
��֪��Zn���������������Al����������������ƣ�pH��11ʱZn(OH)2������NaOH��Һ����[Zn(OH)4]2����
(1)���� pH��������ͨ����� CO2 ʱ������Ӧ�����ӷ���ʽΪ_____��
(2)����˵����ȷ����_____��
A.������� NaOH ��Һ��Ŀ�������пԪ�صĽ�ȡ��
B.���� A ��Ҫ�ɷ��� CuO��FeO
C.ϴ�ӳ���ʱ��ֱ�ӽ�ϴ��Һ����©�������ò������������
D.���ýᾧ�����Դ��Ȼ�п��Һ�л���Ȼ�п����
(3)�Ȼ�п����(ZnCl2xH2O)�ǰ�ɫ���壬�ɺ� 1��1.5��2.5��3��4���ᾧˮ���׳��⣬������ˮ�������Ҵ�����ͪ�����Ȼ�п�����Ʊ���ˮ�Ȼ�п��װ����ͼ�����е�Һ©����ʢ�ŵ��� SOCl2(SOCl2 �۵�Ϊ��105�桢�е� 78.8�桢��ˮ����ˮ������������������)��
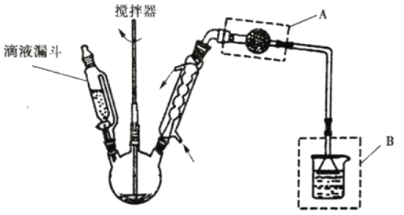
���������������ʺ�ϴ���Ȼ�п�������_____��
A.��ˮ B.Ũ���� C.�Ҵ� D.��ˮ
������ A ������Ϊ_____��װ�� B ��������_____��
���� ZnCl2H2O Ϊ����д��������ƿ�з�����Ӧ�Ļ�ѧ����ʽ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г���һ����N2��H2������ӦN2��g��+3H2��g��![]() 2NH3��g�������NH3Ũ���뷴Ӧ�¶ȹ�ϵ��ͼ������˵����ȷ���ǣ� ��
2NH3��g�������NH3Ũ���뷴Ӧ�¶ȹ�ϵ��ͼ������˵����ȷ���ǣ� ��
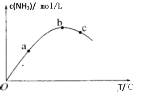
A.�÷�Ӧ��H��0
B.N2ת���ʣ�c��b��a
C.��ѧ��Ӧ���ʣ�c��b��a
D.ƽ�ⳣ��K��b��c��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����ǿ����ʣ�������ˮ�е���ʱ�ɲ�����������(ÿ������ֻ��һ���������һ����ظ�)��
������ | Na����Ba2����NH4+ |
������ | CH3COO����Cl����OH����SO42- |
��֪����A��C��Һ��pH������7����ͬŨ��A��B����Һ��ˮ�ĵ���̶���ͬ����C��Һ��D��Һ����ʱֻ���ɰ�ɫ������B��Һ��C��Һ����ʱֻ���ɴ̼�����ζ�����壬A��Һ��D��Һ���ʱ����������
��1��A��___��B��___��
��2��д��C��D��Ӧ�����ӷ���ʽ___��
��3��25��ʱ��0.1mol��L��1B��Һ��pH��a����B��Һ��c(H��)��c(NH3��H2O)��___(�ú���a�Ĺ�ϵʽ��ʾ)��
��4����������������ʵ���Ũ�ȵ�B��Һ��C��Һ��ϣ���Ӧ����Һ�и�������Ũ���ɴ�С��˳��Ϊ___��
��5����һ�������0.005mol��L��1��C��Һ�У�����һ�������0.00125mol��L��1������ʱ�������Һ��pH��11������Ӧ����Һ���������C��Һ����������֮�ͣ���C��Һ��������������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Լ״���ʯ���ѽ���Ϊԭ�Ͽ��Ƶ�E����֪E�����־����з�����ζ���л�����ɵĻ����������ת����ϵ���£�
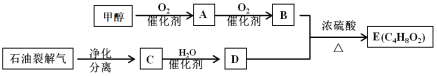
��ش�
��1��д��C�й����ŵĻ�ѧʽ_______________��A�Ľṹ��ʽ��___________________��
��2��C��D�Ļ�ѧ����ʽ��_______________________________ ��_____________________________��
��3��������ͬ�����ŵ��л���ͨ���������ƵĻ�ѧ���ʣ���˿���Ԥ��E������___________��������ƵĻ�ѧ���ʡ���ȥ������B��D��E������е�B��D���ɲ��õķ����ǣ�__________________________________________________________________________��
��4��д��һ����![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ� ![]() �ĺϳ�·�ߡ����������ýṹ��ʽ��ʾ���ɣ��ϳ�·�߳��õı�ʾ��ʽΪ��__________________________________________________________
�ĺϳ�·�ߡ����������ýṹ��ʽ��ʾ���ɣ��ϳ�·�߳��õı�ʾ��ʽΪ��__________________________________________________________![]() ��
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com