
【题目】中国环境监测总站数据显示,颗粒物![]() 等
等![]() 为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对
为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对![]() 、
、![]() 、
、![]() 等进行研究具有重要意义。请回答下列问题:
等进行研究具有重要意义。请回答下列问题:
(1)将![]() 样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 |
|
|
|
|
|
|
浓度 |
|
|
|
|
|
|
根据表中数据计算![]() 待测试样的pH =___________。
待测试样的pH =___________。
(2)汽车发动机工作时会引发![]() 和
和![]() 反应,当尾气中空气不足时,
反应,当尾气中空气不足时,![]() 在催化转化器中被还原成
在催化转化器中被还原成![]() 排出。写出NO被CO还原的化学方程式________。
排出。写出NO被CO还原的化学方程式________。
(3)碘循环工艺不仅能吸收![]() 降低环境污染,同时又能制得氢气,具体流程如下:
降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应_______。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出![]() 的目的是_______。
的目的是_______。
(4)下图是用![]() 脱除烟气中NO的原理。
脱除烟气中NO的原理。
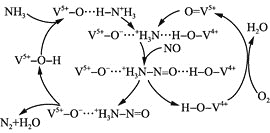
①该脱硝原理中,NO最终转化为 ________![]() 填化学式
填化学式![]() 和H2O。
和H2O。
②当消耗![]() 和
和![]() 时,除去的NO在标准状况下的体积为____L。
时,除去的NO在标准状况下的体积为____L。
【答案】4 ![]()
![]()
![]() 分解为可逆反应,及时分离出产物
分解为可逆反应,及时分离出产物![]() ,有利于反应正向进行
,有利于反应正向进行 ![]() 44.8
44.8
【解析】
![]() 由溶液中电荷守恒进行计算;
由溶液中电荷守恒进行计算;
![]() 在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:
在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:![]() ;
;
![]() 从流程图可知,在反应器中,
从流程图可知,在反应器中,![]() 氧化
氧化![]() ,生成硫酸和HI;
,生成硫酸和HI;
![]() 由题意可知,在HI分解反应中使用膜反应器分离出
由题意可知,在HI分解反应中使用膜反应器分离出![]() 的目的是HI分解为可逆反应,及时分离出产物
的目的是HI分解为可逆反应,及时分离出产物![]() ,有利于反应正向进行;
,有利于反应正向进行;
![]() 根据脱硝原理图,可知NO最终转化为
根据脱硝原理图,可知NO最终转化为![]() ;
;
![]() 、
、![]() 、
、![]() 三者共同反应,生成
三者共同反应,生成![]() 和
和![]() 。
。
![]() 由溶液中电荷守恒:
由溶液中电荷守恒:![]() ,得
,得![]() ,pH值为4;
,pH值为4;
![]() 在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:
在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:;
![]() 从流程图可知,在反应器中,
从流程图可知,在反应器中,![]() 氧化
氧化![]() ,生成硫酸和HI,反应方程式为:
,生成硫酸和HI,反应方程式为:![]() ;
;
![]() 由题意可知,在HI分解反应中使用膜反应器分离出
由题意可知,在HI分解反应中使用膜反应器分离出![]() 的目的是HI分解为可逆反应,及时分离出产物
的目的是HI分解为可逆反应,及时分离出产物![]() ,有利于反应正向进行;
,有利于反应正向进行;
![]() 根据脱硝原理图,可知NO最终转化为
根据脱硝原理图,可知NO最终转化为![]() ;
;
![]() 、
、![]() 、
、![]() 三者共同反应,生成
三者共同反应,生成![]() 和
和![]() 。当消耗
。当消耗![]() 时,失去电子的物质的量为6mol;
时,失去电子的物质的量为6mol;![]() ,得到电子的物质的量为2mol,所以NO得到电子的物质的量为4mol,所以消耗NO的物质的量为2mol,体积为
,得到电子的物质的量为2mol,所以NO得到电子的物质的量为4mol,所以消耗NO的物质的量为2mol,体积为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂和还原剂的物质的量之比最大的是( )
A. 氯气和氨气 3Cl2 + 8NH3 = N2 + 6NH4Cl
B. 铜和稀硝酸3Cu + 8HNO3(稀) = 2NO↑+ 3Cu(NO3)2 + 4H2O
C. 氢气和氧化铁 3H2 + Fe2O3![]() 2Fe + 3H2O
2Fe + 3H2O
D. 二氧化锰和盐酸 MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是
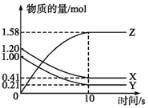
A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M具有广谱抗菌活性,合成M的反应可表示如下,下列说法正确的是
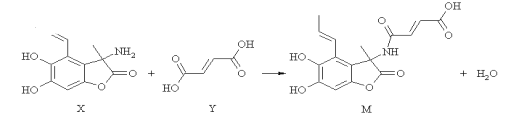
A.X分子中有2个手性碳原子
B.Y分子中所有原子可能在同一平面内
C.可用FeCl3溶液或NaHCO3溶液鉴别X和Y
D.在NaOH溶液中,1 mol M最多可与4 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为___、___。
(2)XZ2与YZ2分子的立体构型分别是__和__,相同条件下两者在水中的溶解度较大的是___(写分子式),理由是__。
(3)Q的元素符号是__,它属于第__周期,它的核外电子排布式为__,在形成化合物时它的最高化合价为___。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机物A为一种无色液体。从A出发可发生如下一系列反应:
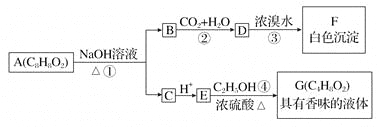
请回答:
(1)写出化合物F的结构简式:________________。
(2)写出反应①的化学方程式:__________________________________________。
(3)写出反应④的化学方程式:___________________________________________。
(4)有机物A的同分异构体很多,其中属于羧酸类的化合物,且含有苯环结构的有________种。
(5)E的一种同分异构体H,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应。试写出H的结构简式:_________________________________。E的另一种同分异构体R在一定条件下也可以发生银镜反应,但不能和金属钠反应放出氢气。试写出R的结构简式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下述操作步骤:①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量![]() 生成
生成![]() 沉淀 ⑤加盐酸生成
沉淀 ⑤加盐酸生成![]() 沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
A.②③④③B.②③⑤③C.①③④③D.②⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)有像食盐一样的咸味,被称为工业盐。已知:亚硝酸是弱酸,且NO+NO2 +2NaOH=2NaNO2+H2O。某同学据此认为NaNO2可与硫酸反应,且有NO和NO2生成,并欲用下图所示仪器(夹持装置已省略)及药品,验证自己的假设。已知沸点:NO2为21℃,NO为-151℃

(1)上述仪器的连接顺序为:A→____→_____→_____→B。
(2)反应前,先打开弹簧夹,通入一段时间氮气,其目的是____________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生了红棕色气体,
① 依据___________________现象,可确认产物中有NO
② 装置E的作用是_________________。
(4)如果没有装置C,对实验结论的影响是____________________。
(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为_______________。
(6)己知:2NaNO2+4HI=2NaI+I2+2NO+2H2O,根据这一反应,可以用试剂和生活中的常见物质鉴别亚硝酸钠和食盐,进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾溶液 C.淀粉 D.白糖 E. 食醋 F.白酒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com