
����Ŀ����һ���2L���ܱ������м��뷴Ӧ��N2��H2���������·�Ӧ��N2(g)��3H2(g)![]() 2NH3(g)����Ӧ�����еIJ����������±���ʾ������˵����ȷ����
2NH3(g)����Ӧ�����еIJ����������±���ʾ������˵����ȷ����
���ʵ���/ mol ʱ��/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0��2 min�ڣ�NH3�ķ�Ӧ����Ϊ0.1 mol��L��1��min��1
B. 2 minʱ�� H2�����ʵ���0.3 mol
C. 4 minʱ����Ӧ�Ѵﵽƽ��״̬����ʱ�����淴Ӧ�����ʶ�Ϊ0
D. 4��6 min�ڣ�������������ӵ������ʵ�������
���𰸡�D
��������
���ݱ������ݿ�֪��
N2(g)+3H2(g)��2NH3(g)
��ʼ��(mol) 1 1.2 0
�仯��(mol)0.1 0.3 0.2
2min��(mol)0.9 0.9 0.2
N2(g)+3H2(g)��2NH3(g)
��ʼ��(mol) 1 1.2 0
�仯��(mol) 0.15 0.45 0.3
4min��(mol) 0.85 0.75 0.3
N2(g)+3H2(g)��2NH3(g)
��ʼ��(mol)1 1.2 0
�仯��(mol) 0.15 0.45 0.3
6min��(mol)0.85 0.75 0.3
A��0��2 min��NH3�ķ�Ӧ����Ϊ�� ��0.05molL��1min��1����A����
��0.05molL��1min��1����A����
B��0��2 min����������H2�����ʵ���0.3 mol��2 minʱH2�����ʵ���0.9mol����B����
C�����ݷ�����֪��4 minʱ��6minʱ����ֵ�Ũ����ȣ�˵���÷�Ӧ�Ѵﵽƽ��״̬������ʱ�����淴Ӧ�����ʲ�����0����C����
D��4��6 min���Ѿ��ﵽƽ��״̬�����淴Ӧ������ȣ���������������ӵ������ʵ������䣬��D��ȷ��
�ʴ�ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ�����ѭ������ͼ��ʾ������˵������ȷ����

A. �ٺ͢�����Ԫ�ؾ�������
B. ���ƻ�ʯȼ�ϵ�ʹ�ÿ��Լ���SO2�ŷ�
C. �����л���ͺ���������ת��
D. ������Ȼ���γ������Ψһԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±����������У����ʼ䲻����ʵ����ͼ![]() ת������( ��)
ת������( ��)
ѡ�� | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | NaOH | NaAlO2 | Al(OH)3 | AlCl3 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����̽���������ʵ����ʡ�
��̽��һ���������װ�ú�ҩƷ̽��������������������ǿ����

(1)װ������˳��Ϊ_____________(����ĸ��ʾ)��F�з�Ӧ�����ӷ���ʽ��_______________
(2)��֤��H2SO3������ǿ��HClO��ʵ��������_____________________________��
��̽������
(3)ijС��ͬѧΪ̽��SO2��Ư�������ʣ�����ͼ��ʾװ�ý���ʵ�飬

�۲쵽��������i�к�ɫ��ȥ��ii���ޱ仯����ʵ���п�֪ʹƷ���ˮ��Һ��ɫ����������_________________________________��
(4)��С��ͬѧ�ֶ�SO2����ˮ�ķ�Ӧ����̽����
����ע��������һ�����ı�����ˮ��SO2�������ã�����������Ʒ����Һ������Ʒ����Һ����ɫ�����ı���ˮ�������ظ�������������Ʒ����Һ��ɫ��ȥ������Ϊ����Ʒ����Һ��ɫ��ԭ�������______________�� ���һ��ʵ��(˵������������������)����֤��ļ���___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NOx)��CO2��SO2���������ɻ������⡣��ȼú�������л�ѧ��������,��ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ�
(1)��֪������״���ȼ���ȷֱ�Ϊ285.8kJ��mol-1��726.5 kJ��mol-1,��CO2��H2��Ӧ����Һ̬�״���Һ̬ˮ���Ȼ�ѧ����ʽΪ___________________________________
(2)��֪��һ���¶��½�6molCO2��8mol H2��������Ϊ2L���ܱ������з������·�Ӧ��CO2(g)+3H2(g)CH3OH(g)+H2O(g) ��H2=-49.0 kJ��mol��1,��
���÷�Ӧ�Է����е������� _______________(���������������������������¶���)
������������˵���˷�Ӧ�ﵽƽ��״̬���� _____________(����ĸ)
a.��������ƽ����Է����������ֲ��� b.CO2��H2�����ʵ���֮�ȱ��ֲ���
c.CO2��H2��ת������� d.3v��(H2)=v��(CH3OH)
e.1mol CO2���ɵ�ͬʱ��3mol H��H������
��H2�����ʵ�����ʱ��仯������ͼʵ����ʾ�����ı�ijһ�����ٽ���ʵ��,���H2���ʵ�����ʱ��仯������ͼ������ʾ����ʵ�����,���߸ı������������__________________

(3)��ͼ��ij�״�ȼ�ϵ�ع�����ʾ��ͼ�����ӽ���Ĥ(ֻ�������ܹ�ͨ��)�����������Һ��Ϊ1L 2mol��L-1H2SO4��Һ���缫a�Ϸ����ĵ缫��ӦʽΪ _____________________�����������1mol e-����ת��ʱ����������Һ������֮��Ϊ____g(���跴Ӧ��ľ�,����������ܽ�)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A. ���Ȼ�����Һ�м�����������ƣ�2Fe3����S2- = 2Fe2����S��
B. �������������������Һ��Fe(OH)3+ 3H�� = Fe3��+ 3H2O
C. ��������Һ�м��������ˮ��Al3��+ 4 NH3��H2O=AlO2- +4 NH![]() + 2 H2O
+ 2 H2O
D. ��NaHSO4��Һ�μ�Ba(OH)2��Һ�����ԣ�2H++SO42-+ Ba2++ 2OH-=BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���һ������ɱ���ܱ������г���2 mol������A��1 mol������B������Ӧ��2A(g)��B(g)![]() 3C(g)����H>0��t1ʱ�̷�Ӧ�ﵽƽ�⣬�����C�������е��������Ϊ��1��t2ʱ�̸ı�ijһ����(������������)��C�������е���������ı仯��ͼ��ʾ����t2ʱ�̸ı��������(����)
3C(g)����H>0��t1ʱ�̷�Ӧ�ﵽƽ�⣬�����C�������е��������Ϊ��1��t2ʱ�̸ı�ijһ����(������������)��C�������е���������ı仯��ͼ��ʾ����t2ʱ�̸ı��������(����)

A. ����1 mol����
B. ����1 mol B
C. ����ѹǿ
D. �����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���������ʵ�鷽������Ũ������ͭƬ��Ӧ�Ʊ�SO2���������ʵ��̽����ʵ��װ����ͼ��ʾ����ش��������⣺

(1)װ��B��������________________��
(2)װ��C�з�����Ӧ�����ӷ���ʽ��_____________________________��
SO2��װ��D����ȫת��Ϊ��ʽ������ӵĹ����У���Һ��ɫ�仯��________��
(3)��֪���ԣ�HCl>H2SO3>HClO����Na2SO3��Һ�м��������ữ��NaClO��Һʱ��֤��NaClO����ʱ���Լ���________��
(4)����Ƽ�ʵ��֤����������HSO3���ĵ���ƽ�ⳣ��Ka������ˮ��ƽ�ⳣ��Kh��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���������ͼװ����ȡ����֤SO2�����ʡ�
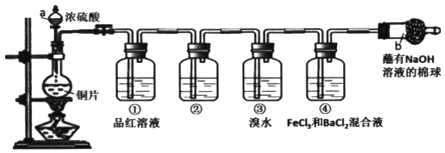
��ش�
��1��д��ͼ�����������ƣ�a________��b________��
��2��������NaOH��Һ��������________��
��3��Ϊ����֤SO2�����������ϴ��ƿ���п�ѡ����Լ���_______��
A ��ɫʯ����Һ B ��ɫ��̪��Һ C ����ʯ��ˮ D ��ˮ
��4������˵����ȷ����_______��
A ʵ�鿪ʼʱ��ֻ���Һ©��������������ʹҺ��˳������
B ����װ���м����Լ���ҩƷ�����ٽ��������Լ��
C ʵ�鿪ʼ��ϴ��ƿ�ٺ͢�����Һ����ɫ�����߾���֤��SO2����Ư����
D ʵ�鿪ʼ��ϴ��ƿ���пɹ۲쵽��ɫ�����������������˵��SO2���л�ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com