
【题目】某研究性学习小组设计了如图装置制取和验证SO2的性质。
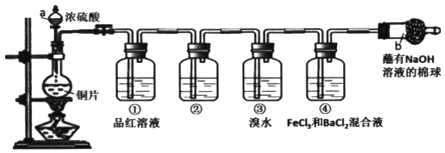
请回答:
(1)写出图中仪器的名称:a________,b________。
(2)棉球中NaOH溶液的作用是________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_______。
A 紫色石蕊试液 B 无色酚酞试液 C 澄清石灰水 D 碘水
(4)下列说法正确的是_______。
A 实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B 先向装置中加入试剂(药品),再进行气密性检查
C 实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D 实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
【答案】分液漏斗 干燥管 吸收尾气,防止SO2污染大气 AC D
【解析】
在加热的条件下铜和浓硫酸反应生成二氧化硫,二氧化硫具有漂白性能使品红溶液褪色,具有还原性能被溴水和氯化铁溶液氧化,最后进行尾气处理,据此分析解答。
(1)图示仪器a为分液漏斗;图示仪器b为干燥管;
(2)二氧化硫有毒,是大气污染物,干燥管为尾气吸收装置,其中的NaOH是用于吸收过量的SO2,防止造成空气污染;
(3)A、SO2通入紫色石蕊试液中,溶液变红色,说明SO2能与水反应形成酸,A符合题意;
B、SO2通入无色酚酞溶液中,溶液不变色,B不符合题意;
C、SO2通入澄清石灰水中,溶液变浑浊,说明SO2能与碱反应,C符合题意;
D、SO2通入碘水中,碘水褪色,说明二者发生反应,体现二氧化硫的还原性,但不能说明SO2是酸性氧化物,D不符合题意;
故答案为:AC。
(4)A、实验开始时,应先打开分液漏斗上口的瓶塞,再打开分液漏斗的旋塞,液体才能顺利滴下,选项错误,A不符合题意;
B、实验开始前,应先检查装置的气密性,再加入药品,选项错误,B不符合题意;
C、洗气瓶①中品红溶液褪色,体现了SO2的漂白性;洗气瓶③中溴水褪色,发生了反应:Br2+SO2+2H2O=2HBr+H2SO4,体现了SO2的还原性,选项错误,C不符合题意;
D、洗气瓶④中产生的白色沉淀为BaSO4,SO42-是SO2被Fe3+氧化而来的,体现了SO2的还原性,选项正确,D符合题意;
故答案为:D。


科目:高中化学 来源: 题型:
【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素化合物在日常生活、化工生产和环境科学中有着重要的用途。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________。
(2)自然界中Cr主要以+3价和+6价形式存在。Cr2O72-中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将Cr2O72-还原。写出反应的离子方程式:___________________________________________。
(3)当皮肤划破时可用FeCl3溶液应急止血,其主要作用是__________________。
(4)高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式Fe(OH)3+ C1O-+ OH-→ FeO42-+ C1-+ H2O(未配平),Fe(OH)3与 C1O-的计量数比为:__________,每生成1mol K2FeO4,转移的电子数是_________。
(5)合成氨及其相关工业中,部分物质间的转化关系如下:

反应IV属于___________反应类型,氮肥主要成分的化学式为_______________,V的化学反应方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍。该电池反应式为:NaMO2+nC![]() Na(1-x)MO2+NaxCn,下列正确的是
Na(1-x)MO2+NaxCn,下列正确的是

A. 充电时,左侧电极为阳极
B. 电解质可以选用无水乙醇
C. 放电时,负极电极反应时为:NaMO2-xe-=Na(1-x)MO2+xNa+
D. 充电时,阳极电极反应式为:nC+xNa-xe-=NaxCn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应.常温下,金属D单质投入水中能与水剧烈反应.常温下E单质是常见的气体.请按要求回答下列几个问题:
(1)B、D的元素名称分别为:_____、_____;
(2)E在周期表中的位置为:_____,
(3)C离子的结构示意图为:_____;
(4)B、C、D三种元素的原子半径从大到小的顺序为_____(用元素符号表示);
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:_____(用对应的化学式表示)
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:_____;
(7)写出E与水反应的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业中废水处理后产生的含重金属污泥废弃物称为电镀污泥,被列入国家危险废物名单中的第十七类危险废物。工业上可利用某电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金金属,其利用回收流程如下:

已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀的pH | 2.1 | 4.7 | 4.3 |
恰好完全沉淀的pH | 3.2 | 6.7 | a |

(1)浸出过程中的生成物主要是Fe2(SO4)3和_______________(填化学式)
(2)除铁等相关操作:
①加入石灰乳调节pH应满足要求是_______________;
②将浊液加热到80℃,趁热过滤。滤渣Ⅱ的主要成分是______________(填化学式)。
(3)还原步骤中生成Cu2O固体的离子反应方程式______________,此步骤中加入NaHSO3的不能过量______________ (离子方程式表达)。
(4)当离子浓度≤1×10-5mol·L-1时认为沉淀完全,则表格中a的值是______________。(已知:T=25℃,Ksp[Cr(OH)3]=6.3×10-31,![]() ,lg2=0.3)
,lg2=0.3)
(5)将铬块加入到稀盐酸或稀硫酸中,可观察到铬逐渐溶解,同时放出氢气。但若将铬块加稀硝酸中,却看不到明显现象。由此推测,出现该现象的可能原因是____________________________。
(6)处理大量低浓度的含铬废水(以CrO42-计)可采用离子交换法,其原理是采用季胺型强碱性阴离子交换树脂(RN—OH),使庞水中CrO42-与树脂上的OH发生离子交换反应。一段时间后停lh 通废水,再通NaOH溶液时CrO42-进入溶液回收,并使树脂得到再生。请用离子方程式表示该交换过程____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用如图所示装置探究甲烷与氯气的反应。根据题意,回答下列问题:

(1)CH4与Cl2发生反应的条件是________;若用日光直射,可能会引起_____________。
(2)实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,________________,__________________等。
(3)实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体-光气,反应的化学方程式为2CHCl3+O2→2COCl2+2HCl,上述反应_______(填选项符号,下同)。
①属于取代反应 ②不属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
A. 平衡不移动
B. 再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C. 再达平衡时,C的体积分数增大
D. 再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.钠在氧气中燃烧,火焰呈黄色,产生白色固体
B.氢气在氯气中燃烧,产生苍白色火焰
C.红热的铜丝在氯气里剧烈燃烧,生成蓝色的烟
D.钠投入水中,浮在水面上熔化成小球,且产生氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com