
【题目】7.8克过氧化钠固体在常温低压下,与一定量的水蒸气反应,最终得到固体16.8克,此固体物质中一定含有
A.NaOH·H2OB.NaOHC.Na2O2·2H2OD.Na2O2·8H2O
【答案】D
【解析】
7.8gNa2O2物质的量为![]() =0.1mol,假设过氧化钠全部反应,由钠原子守恒:得到NaOHH2O为0.2mol,质量为0.2mol×58g/mol=11.6g<16.8g;得到NaOH为0.2mol,质量为0.2mol×40g/mol=8g<16.8g;得到Na2O2·2H2O为0.1mol,质量为0.1mol×114 g/mol=11.4g<16.8g;得到Na2O2·8H2O为0.1mol,质量为0.1mol×222g/mol=22.2g>16.8g;得到的物质质量大于16.8g的就只有D,而反应肯定没有进行完,如果进行完的话上面的物质的分子量没有一个复合,故选D。
=0.1mol,假设过氧化钠全部反应,由钠原子守恒:得到NaOHH2O为0.2mol,质量为0.2mol×58g/mol=11.6g<16.8g;得到NaOH为0.2mol,质量为0.2mol×40g/mol=8g<16.8g;得到Na2O2·2H2O为0.1mol,质量为0.1mol×114 g/mol=11.4g<16.8g;得到Na2O2·8H2O为0.1mol,质量为0.1mol×222g/mol=22.2g>16.8g;得到的物质质量大于16.8g的就只有D,而反应肯定没有进行完,如果进行完的话上面的物质的分子量没有一个复合,故选D。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用如图所示实验装置进行某些气体的制备、物质性质的探究等实验(图中夹持装置省略)。
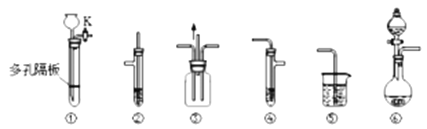
请按要求填空:
(1)实验室制取SO2气体时,可选择的合适试剂___(选填编号)。
a.15%的H2SO4溶液 b.75%的H2SO4溶液 c.Na2SO3固体 d.CaSO3固体
相应的制取装置是___(填图中装置下方编号)。
(2)实验室若用装置①来制取H2S气体,可选择的固体反应物是___(选填编号)。
a.Na2S固体 b.CuS固体 c.FeS固体 d.FeS2固体
反应的离子方程式为___。
(3)如何检验装置①的气密性?简述其操作:___。
(4)实验室里可用浓硫酸和无水酒精反应制取乙烯,除了题中的仪器外,制取装置中还缺少的玻璃仪器是___。
(5)该化学兴趣小组为探究制备乙烯是否存在副产物SO2和CO2,制备的气体从发生装置出来除去乙烯后依次选择了装置②、④、⑤,其中装置②盛有的试剂是___,装置④盛有的试剂是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
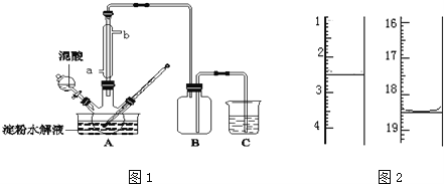
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向等体积pH均为a的CH3COOH溶液和HCN溶液中加水稀释,稀释过程中溶液的pH变化与溶液体积的关系如图所示:
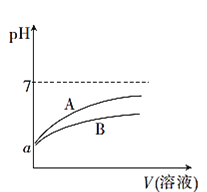
已知25℃时,HCN的电离平衡常数Ka=6.2×10-10,CH3COOH的电离平衡常数Ka=1.7×10-5
(1)表示CH3COOH溶液的pH变化趋势的曲线是____(填“A”或“B”)。
(2)pH均为a的CH3COOH溶液和HCN溶液,溶质的物质的量浓度较大的是____(填化学式)。
(3)25℃时,等浓度的NaCN溶液的pH___填“>”=”或“<”)CH3 COONa溶液的pH。
(4)25℃时,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,当pH=7时,所加KOH溶液的体积____(填或“<”)20mL。
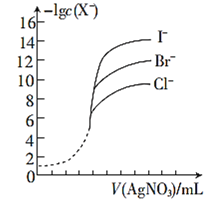
(5)用相同浓度的AgNO3溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是______。(填离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.6gFe投入浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到20gFe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红棕色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为
A.1120mLB.2240mLC.3360mLD.4480mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及其化合物在生活和生产中有很重要的用途。
(1)氨是合成硝酸、铵盐和氮肥的基本原料。在一定条件下用氮气和氢气合成氨气,然后再用氨氧化法制取硝酸。在整个生产过程中,氮气的利用率为85%。写出氨氧化法制取硝酸的反应式____________现有0.2t液态氮,能生产出浓度为40%的硝酸______________千克。
(2)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2 g。
①Cu与Cu2O的物质的量之比?____________
②硝酸的物质的量浓度?___________
(3)将30mLNO和O2混合气体通入过量NaOH溶液中,充分反应后,溶液中只含两种溶质(不考虑水解),且剩余气体体积为2mL。求原混合气体中NO和O2体积比?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3可作食用碱。下列方程式中正确的是( )
A.Na2O2与CO2反应生成Na2CO3:Na2O2 +CO2=Na2CO3+O2
B.Na2CO3溶液呈碱性:CO32-+H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.NaHCO3可作发酵粉:2NaHCO3![]() Na2CO3+CO2↑ +H2O
Na2CO3+CO2↑ +H2O
D.Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com