
���� ��μӷ�Ӧ�ĵ��������ʵ���Ϊnmol����������ʽ��n��ʾ������ֵ����ʵ����ı仯����ƽ��ʱ����ֵ����ʵ������ٸ���NH3�����ʵ����������з��̼���n��ֵ��
��1������v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�
��2������ת���ʵĶ�������������N2��ƽ��ת���ʣ�
��3��ƽ�ⳣ��ָ������Ũ�ȵ�ϵ������֮���뷴Ӧ��Ũ��ϵ������֮���ı�ֵ��ƽ�ⳣ��k=$\frac{c{\;}^{3}��H{\;}_{2}��•c��N{\;}_{2}��}{c{\;}^{2}��NH{\;}_{3��}}$����ͬ�¶��£�ͬһ���淴Ӧ������ƽ�ⳣ����Ϊ������ϵ��
��� �⣺���ڷ�ӦN2��g��+3H2��g�� 2NH3��g��
2NH3��g��
��ʼ��mol����0.6 1.6 0
�仯��mol����n 3n 2n
ƽ�⣨mol����0.6-n 1.6-3n 2n
����$\frac{2nmol}{��o.6-n��mol+��1.6-3n��mol+2nmol}$=$\frac{4}{7}$�����n=0.4��
��1��������ķ�����֪��ƽ��ʱ����ת�������ʵ���Ϊ0.4mol��3=1.2mol������H2��20�����ڵ�ƽ����Ӧ����Ϊ$\frac{\frac{1.2mol}{2.0L}}{20min}$=0.03mol/��L•min����
�ʴ�Ϊ��0.03mol/��L•min����
��2��������ʽ���ⷨ�����֪��ƽ��ʱ�μӷ�Ӧ�ĵ��������ʵ���Ϊ0.4mol��
��ʼʱ�����������ʵ���Ϊ0.6mol��
���Ը�������N2��ƽ��ת����Ϊ$\frac{0.4mol}{0.6mol}$��100%=66.7%��
�ʴ�Ϊ��66.7%��
��������ʽ���ⷨ�����֪��ƽ��ʱ��c��N2��=$\frac{��0.6-0.4��mol}{2L}$=0.1mol/l��c��H2��=$\frac{��1.6-3��0.4��mol}{2L}$=0.2mol/l�� c��NH3��=$\frac{2��0.4mol}{2L}$=0.4mol/l��
���Ը������·�Ӧ2NH3��g��?N2��g��+3H2��g����ƽ�ⳣ��k=$\frac{c{\;}^{3}��H{\;}_{2}��•c��N{\;}_{2}��}{c{\;}^{2}��NH{\;}_{3��}}$=$\frac{0.2{\;}^{3}��0.1}{0.4{\;}^{2}}$=0.005��
�ʴ�Ϊ��0.005��
���� ���⿼��ƽ���ƶ�����㡢ƽ�ⳣ���ȣ��Ѷ��еȣ�ע������ʽ���ⷨ�����ã����ջ����ǽ���ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ϡ���ᡢ���������̼��ͭƬ��ʳ�Ρ���ʯ�ҡ��������١���Ƭ��ľ̿��9�������У�������������ϵ��ѡ��١���Ϊ�ʵ������ʣ�ʹ�����ߵ����������ܷ�����Ӧ��
��ϡ���ᡢ���������̼��ͭƬ��ʳ�Ρ���ʯ�ҡ��������١���Ƭ��ľ̿��9�������У�������������ϵ��ѡ��١���Ϊ�ʵ������ʣ�ʹ�����ߵ����������ܷ�����Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ڢۢ� | C�� | �ۢ� | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
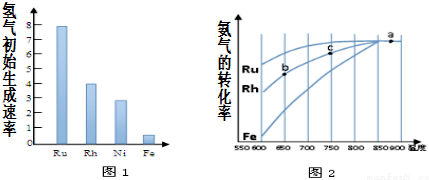
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6 gʯī�е�C-C����Ŀ | |
| B�� | ���³�ѹ�£�17 g ND3������������Ŀ | |
| C�� | ��0.2 mol NH4Al��SO4��2����Һ�еμ�NaOH��Һ��������ȫ�ܽ⣬���ĵ�OH-��Ŀ | |
| D�� | 0.1 mol�ǻ���-OH��������������Ŀ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com