
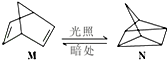
���� ��1��Mת��ΪN�����ȷ�Ӧ������N�������ߣ�����Խ��Խ���ȶ���
��2��ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��ע�ⷴӦ���뻯ѧ�����������ȹ�ϵ��
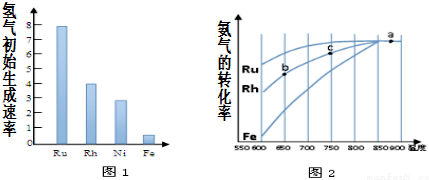
��3�����ݷų�����������μӷ�Ӧ�������ʵ������������㰱��ת���ʣ�
������ʼ��������Խ��˵������������Խ�ߣ�
��b��c��δ�ﵽƽ�⣬��ͬʱ�䣬C���¶Ƚϸߣ���Ӧ���ʽϿ죬��C��İ�����ת���ʽϸߣ�
������Ӱ��ƽ���ƶ���ƽ��ʱת���ʲ��䣬Ni�Ĵ����ܱ�Fe�ߣ�����Rh�ͣ���ͬ�¶��°���ת���ʸ��ڴ���Fe�ġ�С�ڴ���Rh�ģ�
��� �⣺��1��Mת��ΪN�����ȷ�Ӧ������N�������ߣ�����Խ��Խ���ȶ�������Խ��Խ�ȶ������ȶ���M��N��
�ʴ�Ϊ������
��2����1mol Cl2���뷴Ӧʱ�ͷų�145kJ������2mol������Ӧ����290kJ����Ӧ���Ȼ�ѧ����ʽΪ��2Cl2��g��+2H2O��g��+C��s���T4HCl��g��+CO2��g����H=-290kJ•mol-1 ��
�ʴ�Ϊ��2Cl2��g��+2H2O��g��+C��s���T4HCl��g��+CO2��g����H=-290kJ•mol-1 ��
��3���μӷ�Ӧ�������ʵ���Ϊ2mol��$\frac{60.1kJ}{92.4kJ}$=1.3mol���ʰ���ת����Ϊ$\frac{1.3mol}{2mol}$��100%=65%��
������ʼ��������Խ��˵������������Խ�ߣ���ͼ��֪Ru�Ĵ�������ã�
��b��c��δ�ﵽƽ�⣬��ͬʱ�䣬C���¶Ƚϸߣ���Ӧ���ʽϿ죬��C��İ�����ת���ʽϸߣ�
������Ӱ��ƽ���ƶ���ƽ��ʱת���ʲ��䣬Ni�Ĵ����ܱ�Fe�ߣ�����Rh�ͣ���ͬ�¶��°���ת���ʸ��ڴ���Fe�ġ�С�ڴ���Rh�ģ�Ni���ֽⰱ�����̵�������������ͼ�� ��
��
�ʴ�Ϊ��65%��Ru����b��c��δ�ﵽƽ�⣬��ͬʱ�䣬C���¶Ƚϸߣ���Ӧ���ʽϿ죬��C��İ�����ת���ʽϸߣ� ��
��
���� ���⿼�黯ѧ��Ӧ�������仯���Ȼ�ѧ����ʽ��д����ѧƽ����㡢��ѧƽ��ͼ��ȣ����ؿ��������������������Ѷ��еȣ�


 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���յõ�7.8g�ij��� | |
| B�� | ��Ӧ�����еõ�6.72L����״���������� | |
| C�� | ���յõ�����Һ��c��NaCl��=2.0mo/L | |
| D�� | ���յõ�����Һ��AlԪ�ض���Al��OH��3��ʽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������1��1 | B�� | ԭ������1��1 | C�� | ��������1��1 | D�� | �ܶȱ�1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1L0.1mol•L-1�İ�ˮ�к��е�NH3������Ϊ0.1NA | |
| B�� | ��״���£�2.24L��CCl4�к��е�C-Cl����Ϊ0.4NA | |
| C�� | ���³�ѹ�£�3.0g�����Ǻͱ�����Ļ�����к��е�ԭ������Ϊ0.4NA | |
| D�� | ��״���£�Na2O2������CO2��Ӧ����2.24L O2��ת�Ƶ�����Ϊ0.4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij�¶��£��ں����ܱ������У�Ͷ��H2��g����CO2��g��������ʼŨ�Ⱦ�Ϊ0.20mol/L��������Ӧ��H2��g��+CO2��g��?H2O��g��+CO��g����CO��g����Ũ����ʱ��仯��ͼ��ʾ��
ij�¶��£��ں����ܱ������У�Ͷ��H2��g����CO2��g��������ʼŨ�Ⱦ�Ϊ0.20mol/L��������Ӧ��H2��g��+CO2��g��?H2O��g��+CO��g����CO��g����Ũ����ʱ��仯��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������蘆ļ��Էdz�ǿ | |
| B�� | �����������蘆ķе���� | |
| C�� | ��һС���Ͷ��ˮ�У�ʵ���������ƺ�ˮ��Ӧ����ȫ��ͬ | |
| D�� | 錄�����ܶ�ǽ�����Ӧ���γ����ӻ����� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com