
| A. | 最终得到7.8g的沉淀 | |
| B. | 反应过程中得到6.72L(标准状况)的气体 | |
| C. | 最终得到的溶液中c(NaCl)=2.0mo/L | |
| D. | 最终得到的溶液中Al元素都以Al(OH)3形式存在 |
分析 15.6gNa2O2的物质的量为$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物质的量为$\frac{5.4g}{27g/mol}$=0.2mol,首先发生反应2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl.
A.根据m=nM计算生成的氢氧化铝的质量;
B.根据过氧化钠与水反应及铝与氢氧化钠反应计算生成氧气、氢气的总体积;
C.根据Na元素守恒可知反应后溶液中n(Na+)=2n(Na2O2),再根据c=$\frac{n}{V}$计算;
D.Al元素以Al(OH)3、NaAlO2形式存在.
解答 解:15.6gNa2O2的物质的量为$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物质的量为$\frac{5.4g}{27g/mol}$=0.2mol,首先发生反应2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl.
A.最终生成Al(OH)3为0.1mol,质量为0.1mol×78g/mol=7.8g,故A正确;
B.过氧化钠与水反应生成氧气为0.2mol×$\frac{1}{2}$=0.1mol,铝与氢氧化钠反应生成氢气为0.2mol×$\frac{3}{2}$=0.3mol,故生成氢气的体积为(0.1mol+0.3mol)×22.4L/mol=8.96L,故B错误;
C.根据Na元素守恒可知,反应后溶液中n(Na+)=2n(Na2O2)=2×0.2mol=0.4mol,故溶液中c(Na+)=$\frac{0.4mol}{0.2L}$=2mol/L,故C错误;
D.由上述分析可知,Al元素以Al(OH)3、NaAlO2形式存在,故D错误,
故选A.
点评 本题考查混合物的计算、钠的化合物与铝单质及化合物的性质等,难度中等,根据过量计算判断发生的反应是解题的关键.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
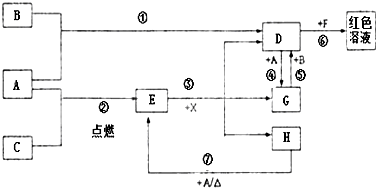 A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体.它们之间的转化如图所示(某些反应条件和部分反应产物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体.它们之间的转化如图所示(某些反应条件和部分反应产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,28 g CO、C2H4混合气体与22.4 L N2所含有的分子数都是NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO3+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.
在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCO3在空气中灼烧 | B. | 铝条插入冷的浓硫酸中 | ||
| C. | Na2O2敞放在空气中 | D. | 向Mg(OH)2悬浊液中加入FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com