



 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
| A、28g氮气所含有的原子数目为NA |
| B、1mol铁与足量稀盐酸反应转移的电子数目为3NA |
| C、标准状况下,22.4L水中含有的水分子数目为NA |
| D、10g重水(2H216O)中含有的中子数目为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,NA个NO分子和0.5 NA个O2分子混合后气体的总体积为33.6 L |
| B、10g D2O晶体中含有的氢氧键数目为NA |
| C、标准状况下,1 mol SO3分子体积约为22.4 L |
| D、常温常压下,1 mol氦气含有的核外电子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
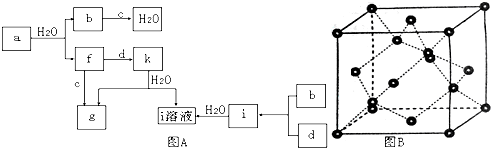
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素. |
| B元素原子的核外p电子数比s电子数少1. |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满. |
| E元素的主族序数与周期数的差为4. |
| F是前四周期中电负性最小的元素. |
| G在周期表的第七列. |


查看答案和解析>>
科目:高中化学 来源: 题型:
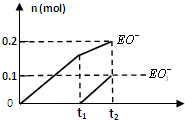 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体的种类 |
| B、气体的物质的量 |
| C、气体分子本身的大小 |
| D、气体分子之间的平均距离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com