
【题目】常温下,浓度均为![]() 的HX、HY溶液各20mL,分别用
的HX、HY溶液各20mL,分别用![]() 的NaOH溶液滴定。溶液的pH与NaOH溶液体积V的关系如图所示,下列推断中不正确的是
的NaOH溶液滴定。溶液的pH与NaOH溶液体积V的关系如图所示,下列推断中不正确的是

A.A点存在:![]()
B.B点存在:![]()
C.C点存在:![]()
D.向NaX溶液中滴加HY溶液发生反应:![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】肼![]() 又称联氨,是一种可燃性的液体,可用作火箭燃料,其燃烧产物为无害物质。已知在
又称联氨,是一种可燃性的液体,可用作火箭燃料,其燃烧产物为无害物质。已知在![]() ,101kPa时,
,101kPa时,![]() 的燃烧热为
的燃烧热为![]() ,其分子的球棍模型如图所示。下列说法正确的是( )
,其分子的球棍模型如图所示。下列说法正确的是( )

A.标准状况下,![]() 含有共价键的总数为
含有共价键的总数为![]()
B.![]() 和
和![]() 含有的电子总数不相等
含有的电子总数不相等
C.在![]() ,101kPa时,若
,101kPa时,若![]() 充分燃烧放出624kJ热量,则转移电子的数目为
充分燃烧放出624kJ热量,则转移电子的数目为![]()
D.![]() 和
和![]() 含有的化学键类型完全相同
含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2 。下列关于该电池的说法错误的是( )

A. 食盐水作为电解质溶液
B. 电池工作时镁片作为正极逐渐被消耗
C. 电池工作时实现了化学能向电能的转化
D. 活性炭电极上的反应为O2+2H2O + 4e- = 4OH -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于溶液的酸碱性说法正确的是
A.含OH-的溶液一定呈碱性B.在100°C时,纯水的pH<7,因此显酸性
C.c(H+)=c(OH-)的溶液一定呈中性D.pH=14的溶液碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. 电离常数:Ka(HB)>Ka(HA)
B. Ka(HA)的数量级为10-5
C. 当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D. 等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
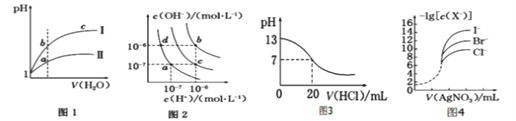
A. 图1表示同温度下,pH=1 的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线Ⅱ为醋酸,且a 点溶液的导电性比b 点强
B. 图2 中纯水仅升高温度,不能使a点变到c点
C. 图3 表示25 ℃时,用0.100 0 molL-1HCl 滴定20 mL 0.100 0 molL-1NaOH 溶液,溶液的pH随加入盐酸体积的变化
D. 用0.010 0 molL-1AgNO3标准溶液滴定浓度均为0.100 0 molL-1Cl-、Br-及I-的混合溶液,由图4 曲线,可确定首先沉淀的是I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol/L的氨水滴入10mL0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A.a点KW=1.0×10-14
B.水的电离程度:b>c>a>d
C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,一水合氨的电离平衡常数为10-7/(10n-1)(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是制备电池的重要原料。室温下,
是制备电池的重要原料。室温下,![]() 溶液的pH随
溶液的pH随![]() 的变化如图甲所示,
的变化如图甲所示,![]() 溶液中
溶液中![]() 的分布分数
的分布分数![]() 随pH的变化如图乙所示
随pH的变化如图乙所示 。
。

下列有关![]() 溶液的叙述正确的是
溶液的叙述正确的是 ![]()
![]()
A.溶液中存在3个平衡
B.含P元素的粒子有![]() 、
、![]() 和
和![]()
C.随![]() 增大,溶液的pH明显变小
增大,溶液的pH明显变小
D.用浓度大于![]() 的
的![]() 溶液溶解
溶液溶解![]() ,当pH达到
,当pH达到![]() 时,
时,![]() 几乎全部转化为
几乎全部转化为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com