
| A. | 限制使用电动车 | |
| B. | 利用太阳能、风能和氢能等能源代替化石燃料 | |
| C. | 鼓励私人购买和使用汽车代替公交车 | |
| D. | 以煤等燃料作为主要生活燃料 |
分析 改善环境质量应减少污染物的排放,例如减少废气、废水、废渣,减少C02的排放等,多使用清洁能源,少使用化石能源.
解答 解:A.使用电动车不会产生污染,故限制使用电动车不能改善空气质量,故A错误;
B.利用太阳能、风能和氢能等能源替代化石能源,可以减少有害气体的排放,解决能源问题的最佳方法是开发新能源,故B正确;
C.汽车尾气中含有氮氧化物和硫氧化物,会严重污染大气,应少用私家车,故C错误;
D.以煤作为主要生活燃料会产生大量污染物,如:C0、C02、S02等有害气体,污染大气,温室效应、导致酸雨等环境问题,故D错误.
故选B.
点评 本题考查环境污染问题,减轻空气污染、改善空气质量的根本措施是减少污染物的排放,题目难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
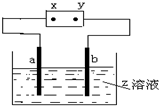 如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( ) | a极板 | b极板 | x电极 | Z溶液 | |
| A | 铜 | 银 | 负极 | CuCl2 |
| B | 石墨 | 石墨 | 正极 | NaOH |
| C | 铁 | 石墨 | 负极 | CuSO4 |
| D | 铜 | 银 | 正极 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  | 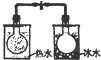 |
| 根据电流表(A)中指针是否偏转即可比较Zn,Cu的金属活泼性 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 | 根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
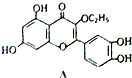
| A. | A的分子式为C17H14O7 | |
| B. | 一个A分子中含有三个苯环且A分子中无手性碳原子 | |
| C. | A可用有机溶剂萃取 | |
| D. | 1molA与足量的NaOH 溶液反应,最多可以消耗4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲电极为阴极 | |
| B. | 为使电解产物全部转化为NH4NO3,需补充的物质为NH3 | |
| C. | 乙电极的电极反应式是:NO-3e-+4OH-=NO3-+2H2O | |
| D. | 该反应中NO既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com