
用NA表示阿伏加德罗常数,下列有关说法正确的是
A.71 g Cl2所含原子数为2NA
B.在常温常压下,1 mol氦气含有的原子数为2NA
C.0.1L 0.5 mol/L CH3COOH溶液中含有的氢离子数为0.05NA
D.标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L
科目:高中化学 来源:2017届宁夏银川市高三上学期第三次月考化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学】功能高分子P的合成路线如下:
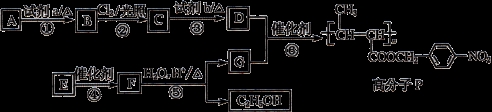
(1)A的分子式是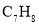 ,其结构简式是 。
,其结构简式是 。
(2)试剂a是 。
(3)反应③的化学方程式: 。
(4)E的分子式是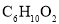 。E中含有的官能团: 。
。E中含有的官能团: 。
(5)反应④的反应类型是 。
(6)反应⑤的化学方程式: 。
(7)已知: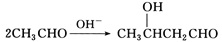 以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一上月考三化学卷(解析版) 题型:选择题
下列各项操作中最终有沉淀生成的是( )
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中滴加少量稀H2SO4
③向BaCl2溶液中通CO2
④向石灰水中逐渐通入CO2至过量
⑤向NaHSO4溶液中逐滴滴加Ba(OH)2至过量
A.②③⑤ B.①②⑤ C.②③④⑤ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:实验题
NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:
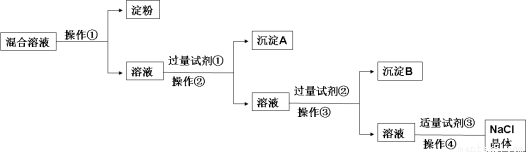
(1)写出上述实验过程中所用试剂:试剂① ;试剂③ 。
(2)判断试剂①已过量的方法是: 。
(3)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉 (填“能”或“不能”)
透过半透膜;SO42- (填“能”或“不能”)透过半透膜。
(4)操作④的名称是 。
(5)实验室用制得的NaCl晶体配制480mL1.0mol/L的NaCl溶液,用托盘天平称量的氯化钠固体的质量是 ,配制过程用到的玻璃仪器除量筒、烧杯、胶头滴管外,还有 。
分析以下操作对配制的溶液浓度造成的影响,影响偏高的是 。
①蒸馏水洗完容量瓶后没有烘干
②转移溶液过程中出现漏液
③溶解后未经冷却就转移到容量瓶
④定容时俯视
⑤摇匀后发现液面降低,再加蒸馏水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种 离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A.1∶2 B.1∶4 C.3∶4 D.3∶2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是
A.Ⅰ中溶液分层,下层呈紫红色
B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色
D.Ⅳ中溶液不分层,溶液没有颜色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
下列各表述与示意图一致的是( )
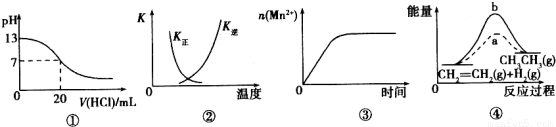
A.图①表示25℃时,用0.1 moI·L-1盐酸滴定20 mL0.l mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g) 2SO3(g) ΔH<0, 正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH<0, 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.0l moI·L-1 KMnO4酸性溶液与过量的0.l moI·L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g) CH3CH3(g) △H<0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g) △H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学试卷(解析版) 题型:选择题
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是
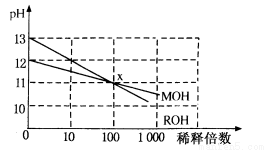
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:填空题
N2H4通常用作火箭的高能燃料,N2O4作氧化剂。请回答下列问题:
(1)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+a kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-b kJ/mol
2NO2(g)N2O4(g) ΔH=-c kJ/mol
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式__________________。
(2) N2、H2合成氨气为放热反应。800 K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡。
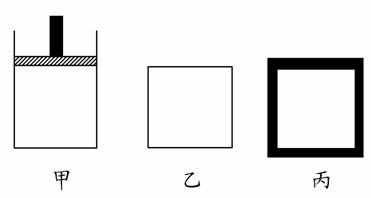
①达到平衡时,平衡常数K甲__________K乙__________K丙(填“>”、“<”或“=”)。
②达到平衡时N2的浓度c(N2)甲__________c(N2)乙,c(N2)乙__________c(N2)丙(填“>”、“<”或“=”)。
③对甲、乙、丙三容器的描述,以下说法正确的是__________。
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率加快
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com