


分析 (1)形成原电池时,Fe作正极被保护;电解池中Fe作阴极被保护;C为阳极,阳极接石墨,不需要频繁更换;
(2)①Cr比铜活泼,Cr为负极,Cu为正极,正极上氢离子得电子;
A、盐桥中不是都可以用饱和KCl琼脂溶液,要考虑能否与电解质溶液反应;
B、1molCr反应,转移2mol电子;
C、氢离子得电子发生还原反应;
D、盐桥中是离子移动,无电子通过;
②正极上是硝酸根离子得电子生成NO,结合电荷守恒和原子守恒书写电极反应式;
(3)根据发生的电极反应,可以知道金属铁是阴极,石墨电极是阳极,根据电解质中离子的放电顺序以及电极反应和电子的转移知识来回答即可.
解答 解:(1)原电池原理保护金属铁时,将铁与比铁活泼的金属相连,属于牺牲阳极的阴极保护法;电解池原理保护金属铁时,铁作阴极,阳极接石墨,不需要频繁更换;
故答案为:牺牲阳极的阴极保护法;d;
(2)①Cr比铜活泼,Cr为负极,Cu为正极,正极上氢离子得电子,所以铜电极上有气泡生成;
A、盐桥中不是都可以用饱和KCl琼脂溶液,若电解质溶液为硝酸银溶液时,会生成沉淀,故A错误;
B、1molCr反应,转移2mol电子,为保持电荷守恒,盐桥中将有2molCl-进入左池,2molK+进入右池,故B正确;
C、氢离子得电子发生还原反应,故C错误;
D、盐桥中是离子移动,无电子通过,故D错误;
故答案为:铜电极上有气泡产生;B;
②正极上是硝酸根离子得电子生成NO,有氢离子参与反应,电极反应式为:4H++NO3-+3e-=NO↑+2H2O,
故答案为:4H++NO3-+3e-=NO↑+2H2O;
(3)①根据发生的电极反应,可以知道金属铁是阴极,接电源的负极,故答案为:负极;
②阴极上氢离子放电发生还原反应,生成氢气,阳极发生氧化反应,阳极的电极反应式为:CN--2e-+2OH-═CNO-+H2O和2Cl--2e-═Cl2↑,
故答案为:CN--2e-+2OH-═CNO-+H2O.
点评 本题考查了原电池原理和电解池原理的分析应用,把握原电池原理和电解池原理以及电解过程中电子的移动方向,掌握基础是关键,题目难度中等,侧重于考查学生的分析能力.


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑤ | C. | ①③④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯中的电子总数为12NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 5.85g氯化钠晶体中含有Na+数为0.1NA | |
| D. | 氢气和氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)→CO2(g)+393kJ | B. | C+O2→CO2+393kJ | ||
| C. | C(s)+O2(g)→CO2(g)-393kJ | D. | C(s)+1/2O2(g)→CO(g)+393kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
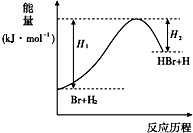
| A. | 正反应为放热反应 | |
| B. | 反应物总能量高于生成物总能量 | |
| C. | 升高温度可增大正反应速率,降低逆反应速率 | |
| D. | 加入催化剂,该化学反应的反应物的总能量与生成物的总能量差不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: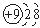 | B. | O-18的原子符号:${\;}_{10}^{18}$O | ||
| C. | NaCl的电子式: | D. | N2的结构式::N≡N: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com