
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,CO2的体积分数增加。下列关于该过程的判断错误的是( )
CH4(g)+2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,CO2的体积分数增加。下列关于该过程的判断错误的是( )
A.该反应的△S<0B.正反应速率增大,逆反应速率也增大且增加的倍数更大
C.化学平衡常数K增大D.CH4的产率降低
【答案】C
【解析】
温度升高,二氧化碳体积分数增加,说明平衡逆向移动,正反应放热;CO2(g)+4H2(g)CH4(g)+2H2O(g)是一个气体总体积减小的熵变减小的放热反应,据此进行分析。
A.该反应正向是一个气体计量系数减小的反应,该方向是一个熵减的过程,即△S<0,不符合题意,A项错误;
B.结合以上分析可知,正反应为放热反应;升温后,正、逆反应速率都增大,但逆向速率增大更多,逆反应速率大于正向速率,不符合题意,B项错误;
C.温度升高,平衡逆向移动,化学平衡常数K减小,符合题干要求,C项正确;
D.温度升高,平衡逆向移动,CH4的产率降低,不符合题干要求,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.用石灰石或石灰乳进行燃煤烟气脱硫![]() 除
除![]() 可获得副产品石膏
可获得副产品石膏
B.金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法
C.若在水果贮藏室中,放几块被![]() 溶液浸透过的“砖块”,可延长水果保存时间
溶液浸透过的“砖块”,可延长水果保存时间
D.常温时,某可逆反应的平衡常数越大则其反应速率就越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )

A.Cr含量小于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
B.Cr含量等于13%时,三种酸对Fe-Cr合金的腐蚀速率由快到慢的顺序为H2SO4>HCl>HNO3
C.随着Fe含量的增加,Fe-Cr合金在5%HNO3中的耐腐蚀性越来越弱
D.稀硫酸对Fe-Cr合金的腐蚀性比稀硝酸和稀盐酸都强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
(1)含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:
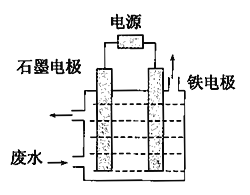
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为_____________(填“阴极”或“阳极”),阳极产生的ClO-的电极反应为_______________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为___________________________________。
(2)可用以下方法测定处理后的废水中NaCN的含量。已知:Ⅰ.废水中NaCN 的最高排放标准为0.50mg/L;Ⅱ.Ag+ +2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI沉淀呈黄色,且CN- 优先与Ag+反应。实验如下:20.00mL处理后的含NaCN 的废水于锥形瓶中,并滴加几滴KI 溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为15.00mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用_________________(填仪器名称)盛装;滴定终点时的现象是____________________________。
②处理后的含NaCN 的废水是否达到排放标准____________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
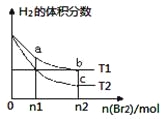
A. 若b、c点的平衡常数分别为K1、K2,则K1>K2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法
D. 若平衡后保持温度不变,压缩容器体积平衡一定不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.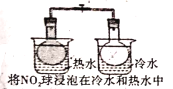 气体在热水中比在冷水中颜色深
气体在热水中比在冷水中颜色深
B.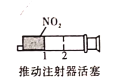 加压后气体颜色先变深后变浅
加压后气体颜色先变深后变浅
C.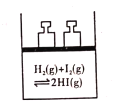 平衡体系加压后颜色变深
平衡体系加压后颜色变深
D.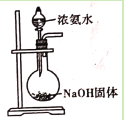 用浓氨水和NaOH固体制取氨气
用浓氨水和NaOH固体制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒温恒压密闭容器中投入2molSO3发生反应:2SO3(s) ![]() 2SO2(g)+O2(g) △H= +akJ·mol-1(a>0),2min后达到平衡,此时SO2的物质的量为0.8mol,下列说法正确的是( )
2SO2(g)+O2(g) △H= +akJ·mol-1(a>0),2min后达到平衡,此时SO2的物质的量为0.8mol,下列说法正确的是( )
A.用SO3表示的反应速率为0.2mol·L-1·min-1
B.若O2的体积分数不变,证明该可逆反应已达平衡
C.在2min时,v正(SO2)=2v逆(O2)
D.平衡后,再投入2 mol SO3,则正反应速度加快,逆反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述 ![]() 分子结构的下列叙述中,正确的是
分子结构的下列叙述中,正确的是
A.6个碳原子有可能都在一条直线上B.6个碳原子一定都在同一平面上
C.6个碳原子不可能都在同一平面上D.所有原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定的密闭容器中,达平衡的可逆反应2A(g)![]() 2B(?) + C (?)(△H>0),若随着温度升高,气体平均相对分子质量减小,则下列判断正确的是:( )
2B(?) + C (?)(△H>0),若随着温度升高,气体平均相对分子质量减小,则下列判断正确的是:( )
A. B和C可能都是液体 B. B和C肯定都是气体
C. B和C可能都是固体 D. 若C为固体,则B一定是气体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com