
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.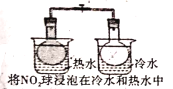 气体在热水中比在冷水中颜色深
气体在热水中比在冷水中颜色深
B.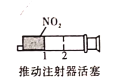 加压后气体颜色先变深后变浅
加压后气体颜色先变深后变浅
C.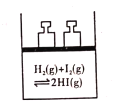 平衡体系加压后颜色变深
平衡体系加压后颜色变深
D.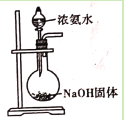 用浓氨水和NaOH固体制取氨气
用浓氨水和NaOH固体制取氨气
【答案】C
【解析】
A.2NO2![]() N2O4 是放热反应,温度升高平衡逆向移动,NO2浓度增大颜色加深,故在热水中比冷水中颜色深,此处是平衡的移动,能用勒夏特列原理解释,A项错误;
N2O4 是放热反应,温度升高平衡逆向移动,NO2浓度增大颜色加深,故在热水中比冷水中颜色深,此处是平衡的移动,能用勒夏特列原理解释,A项错误;
B.加压瞬间NO2浓度增大,颜色加深,后平衡正向移动,向生成N2O4方向移动,NO2浓度减小,故颜色变浅,B项错误;
C. I(g)+ H(g) ![]() 2HI(g),两边气体计量系数之和相等,加压平衡不移动,此处颜色加深是因为:加压体积缩小,碘单质的浓度增大了,与平衡移动无关, C项正确;
2HI(g),两边气体计量系数之和相等,加压平衡不移动,此处颜色加深是因为:加压体积缩小,碘单质的浓度增大了,与平衡移动无关, C项正确;
D. NH3(g)+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,加氢氧化钠固体就是增加OH-的浓度,化学平衡向左移动,释放出NH3,D项错误;
NH4++OH-,加氢氧化钠固体就是增加OH-的浓度,化学平衡向左移动,释放出NH3,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中进行反应:A(s)+2B(g)![]() C(g)+D(g),不能说明该反应已达到化学平衡的是
C(g)+D(g),不能说明该反应已达到化学平衡的是
A.B的体积分数不随时间变化而变化
B.压强不随时间变化而变化
C.混合气体的密度不再发生改变
D.单位时间内生成n mol A,同时生成n molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )

A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钠![]() 化合物中钠元素是
化合物中钠元素是![]() 价,NaH跟水反应放出
价,NaH跟水反应放出![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
A.在NaH中的氢离子半径比锂离子半径大
B.在NaH中的氢离子的电子层排布与![]() 不相同
不相同
C.NaH跟水反应后溶液呈酸性
D.NaH中的氢离子被还原成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,CO2的体积分数增加。下列关于该过程的判断错误的是( )
CH4(g)+2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,CO2的体积分数增加。下列关于该过程的判断错误的是( )
A.该反应的△S<0B.正反应速率增大,逆反应速率也增大且增加的倍数更大
C.化学平衡常数K增大D.CH4的产率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为_________(填字母,装置可多次使用);C中盛放的试剂是_____________。
③该制备装置的缺点为________________。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的名称是__________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5C1的操作方法是______。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:________(写出一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的装置如图:
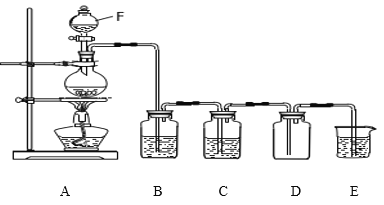
(1)仪器F的名称是_____________;按图组装好装置后首先要进行的操作是:_________________。
(2)写出E中发生反应的离子方程式:_____________________________________________________。
(3)实验室也可以用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,则该反应的氧化产物是_____________________。
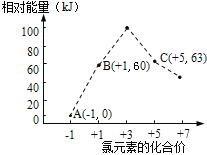
(4)氯元素能形成多种离子。在水溶液中1 mol Cl-、1 molClOx-(x=1,2,3,4)能量的相对大小如图所示,试判断B→A+C反应是___________反应(填“吸热”或“放热”);若有1.5molB发生反应,转移电子的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】幸福可以“人工合成”吗?精神病学专家通过实验发现,人体中的一种脑内分泌物多巴胺,可影响一个人的情绪。多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质。这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐。多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下:
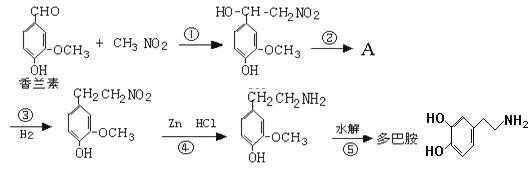
请回答下列问题:
(1)写出香兰素中含有的官能团的名称是___________________。
(2)上述合成过程中属于加成反应的是 (填反应序号)_____________。
(3)反应②的反应条件是__________。有机物A的结构简式为____________。
(4)写出符合下列条件的多巴胺的所有同分异构体的结构简式:_______________。
(i)属于1,3,5-三取代苯 (ii)苯环上直接连有一个羟基和一个氨基
(iii)分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2∶1
(5)多巴胺遇足量浓溴水会产生沉淀,请写出该反应的化学方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com