
【题目】在一定温度下的定容密闭容器中进行反应:A(s)+2B(g)![]() C(g)+D(g),不能说明该反应已达到化学平衡的是
C(g)+D(g),不能说明该反应已达到化学平衡的是
A.B的体积分数不随时间变化而变化
B.压强不随时间变化而变化
C.混合气体的密度不再发生改变
D.单位时间内生成n mol A,同时生成n molC
科目:高中化学 来源: 题型:
【题目】目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中![]() 的含量及有效地开发利用
的含量及有效地开发利用![]() ,引起全世界的关注:
,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒![]() 杂质
杂质![]() ,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为
,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为![]() ,请写出对应的化学方程式并配平: ______ ;
,请写出对应的化学方程式并配平: ______ ;
(2)将不同量的![]() 和
和![]() 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应![]()
![]() ,得到如下两组数据:
,得到如下两组数据:
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所 需时间 | ||
| CO |
| CO | |||
1 | 650 | 2 | 4 |
|
| 5 |
2 | 900 | 1 | 2 |
|
| 3 |
①实验2条件下平衡时![]() 体积分数为 ______ ;
体积分数为 ______ ;
②下列方法中可以证明上述已达平衡状态的是 ______ ;
![]() 单位时间内生成nmol
单位时间内生成nmol![]() 的同时生成nmolCO
的同时生成nmolCO
![]() 容器内压强不再变化
容器内压强不再变化![]() 混合气体密度不再变化
混合气体密度不再变化
![]() 混合气体的平均相对分子质量不再变化
混合气体的平均相对分子质量不再变化![]() 的质量分数不再变化
的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值![]() 如下表,则反应
如下表,则反应![]() ,在900K时,该反应平衡常数的对数值
,在900K时,该反应平衡常数的对数值![]() ______ .
______ .
气化反应式 | lgK | ||
700K | 900K | 1200K | |
|
|
|
|
|
|
|
|
(3)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
![]()
![]()
![]()
![]()
![]()
![]()
请写出CO除![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
(4)![]() 时,
时,![]() 和
和![]() 的溶度积常数分别是
的溶度积常数分别是![]() 和
和![]() ,某含有
,某含有![]() 沉淀的悬浊液中
沉淀的悬浊液中![]() ,如果加入等体积的
,如果加入等体积的![]() 溶液,若要产生
溶液,若要产生![]() 沉淀,加入
沉淀,加入![]() 溶液的物质的量浓度最小是 ______
溶液的物质的量浓度最小是 ______ ![]() .
.
(5)![]() 时,在
时,在![]() 醋酸中加入V
醋酸中加入V![]() 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .
溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .

A.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液中,由水电离出的
溶液中,由水电离出的![]() 相等
相等
B.①点时![]() ,此时溶液中,
,此时溶液中,![]()
C.②点时,溶液中的![]()
D.③点时![]() ,此时溶液中
,此时溶液中![]()
(6)如图是一种新型燃料电池,它以CO为燃料,一定比例的![]() 和
和![]() 熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:
熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:

①写出A极发生的电极反应式 ______ ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与 ______ 极![]() 填“C”或“D”
填“C”或“D”![]() 相连.
相连.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Fe3+的除杂,说法不正确的是( )
A.用加热的方法可除去KNO3溶液中混有的Fe3+
B.工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可除去Fe3+
C.FeSO4溶液中的Fe2+极易被氧化为Fe3+,可加铁粉除去杂质Fe3+
D.MgCl2溶液中混有FeCl3杂质,可加Na2CO3除去FeCl3杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇属于可再生能源,可作汽车的燃料,下列能正确表示甲醇燃烧热的热化学方程式为
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=+763.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=+763.3 kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-763.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-763.3 kJ·mol-1
C.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 526.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.用石灰石或石灰乳进行燃煤烟气脱硫![]() 除
除![]() 可获得副产品石膏
可获得副产品石膏
B.金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法
C.若在水果贮藏室中,放几块被![]() 溶液浸透过的“砖块”,可延长水果保存时间
溶液浸透过的“砖块”,可延长水果保存时间
D.常温时,某可逆反应的平衡常数越大则其反应速率就越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置的叙述中正确的是( )

A.用此装置给铁镀铜,镀件应放在b电极
B.用此装置给铁镀铜,反应一段时间后溶液中铜离子浓度基本不变
C.用此装置电解精炼铜,反应一段时间后溶液中铜离子浓度基本不变
D.用此装置电解精炼铜,粗铜应放在a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
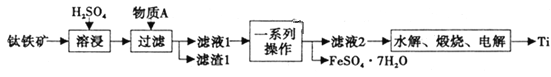
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为________。
(2)物质A为________(填化学式),“一系列操作”为________。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________、________。(写出两条)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为________;若制得金属Ti 9.60g,阳极产生气体________mL(标准状况下)。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式________;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:

(1)Cr2O72-中元素铬(Cr)的化合价为_____。
(2)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入![]() 溶液直至过量,可观察到的现象是____。
溶液直至过量,可观察到的现象是____。
(3)CrO42-和Cr2O72-在溶液中可相互转化:2CrO42-+2H+![]() Cr2O72-+H2O,室温下,初始浓度为1.0molL-1的Na2CrO4溶液中,c(Cr2O72-)随c(H+)的变化如图所示。
Cr2O72-+H2O,室温下,初始浓度为1.0molL-1的Na2CrO4溶液中,c(Cr2O72-)随c(H+)的变化如图所示。
①溶液酸性增大,CrO42-的平衡转化率_________。(填“增大”“减小”或“不变”)。
②根据A点数据,计算出该转化反应的平衡常数为___________。
③温度升高,溶液中CrO42-的平衡转化率减小,则该反应的ΔH____0(填“>、=、<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.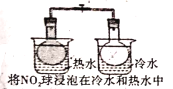 气体在热水中比在冷水中颜色深
气体在热水中比在冷水中颜色深
B.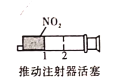 加压后气体颜色先变深后变浅
加压后气体颜色先变深后变浅
C.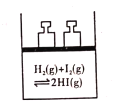 平衡体系加压后颜色变深
平衡体系加压后颜色变深
D.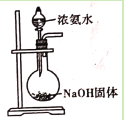 用浓氨水和NaOH固体制取氨气
用浓氨水和NaOH固体制取氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com