
【题目】目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中![]() 的含量及有效地开发利用
的含量及有效地开发利用![]() ,引起全世界的关注:
,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒![]() 杂质
杂质![]() ,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为
,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为![]() ,请写出对应的化学方程式并配平: ______ ;
,请写出对应的化学方程式并配平: ______ ;
(2)将不同量的![]() 和
和![]() 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应![]()
![]() ,得到如下两组数据:
,得到如下两组数据:
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所 需时间 | ||
| CO |
| CO | |||
1 | 650 | 2 | 4 |
|
| 5 |
2 | 900 | 1 | 2 |
|
| 3 |
①实验2条件下平衡时![]() 体积分数为 ______ ;
体积分数为 ______ ;
②下列方法中可以证明上述已达平衡状态的是 ______ ;
![]() 单位时间内生成nmol
单位时间内生成nmol![]() 的同时生成nmolCO
的同时生成nmolCO
![]() 容器内压强不再变化
容器内压强不再变化![]() 混合气体密度不再变化
混合气体密度不再变化
![]() 混合气体的平均相对分子质量不再变化
混合气体的平均相对分子质量不再变化![]() 的质量分数不再变化
的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值![]() 如下表,则反应
如下表,则反应![]() ,在900K时,该反应平衡常数的对数值
,在900K时,该反应平衡常数的对数值![]() ______ .
______ .
气化反应式 | lgK | ||
700K | 900K | 1200K | |
|
|
|
|
|
|
|
|
(3)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
![]()
![]()
![]()
![]()
![]()
![]()
请写出CO除![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
(4)![]() 时,
时,![]() 和
和![]() 的溶度积常数分别是
的溶度积常数分别是![]() 和
和![]() ,某含有
,某含有![]() 沉淀的悬浊液中
沉淀的悬浊液中![]() ,如果加入等体积的
,如果加入等体积的![]() 溶液,若要产生
溶液,若要产生![]() 沉淀,加入
沉淀,加入![]() 溶液的物质的量浓度最小是 ______
溶液的物质的量浓度最小是 ______ ![]() .
.
(5)![]() 时,在
时,在![]() 醋酸中加入V
醋酸中加入V![]() 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .
溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .

A.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液中,由水电离出的
溶液中,由水电离出的![]() 相等
相等
B.①点时![]() ,此时溶液中,
,此时溶液中,![]()
C.②点时,溶液中的![]()
D.③点时![]() ,此时溶液中
,此时溶液中![]()
(6)如图是一种新型燃料电池,它以CO为燃料,一定比例的![]() 和
和![]() 熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:
熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:

①写出A极发生的电极反应式 ______ ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与 ______ 极![]() 填“C”或“D”
填“C”或“D”![]() 相连.
相连.
【答案】![]()
![]() ae
ae ![]()
![]()
![]() BC
BC ![]() D
D
【解析】
(1)由题目信息可知,C与K2MnO4在硫酸条件下反应生成CO2、MnSO4、K2SO4与H2O,反应中K2MnO4中锰元素化合价降低4价,碳元素化合价升高4价,化合价升降最小公倍数为4,故K2MnO4前的系数是1,碳单质前的系数是1,再根据原子守恒配平;
(2)①根据氢气物质的量计算消耗水的物质的量,再计算平衡时水的物质的量,反应前后气体物质的量不变,则平衡时混合气体总物质的量为3mol,进而计算平衡时水的体积分数;
②可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量不变,由此衍生的其它一些物理量不变,判断平衡的物理量应随反应的进行发生改变,该物理量由变化到不变化说明到达平衡;
③已知:Ⅰ.C(s)+H2O(g)=CO(g)+H2(g),令平衡常数为K1,
Ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g),令平衡常数为K2,
则ⅡⅠ可得:CO(g)+H2O(g)CO2(g)+H2(g),故该反应平衡常数K=![]() ;
;
(3)已知:①C(s)+O2(g)=CO2(g) △H1=393.5kJmol1
②CO2(g)+C(s)=2CO(g) △H2=+172.5kJmol1
③S(s)+O2(g)=SO2(g) △H3=296.0kJmol1
根据盖斯定律,①②③可得:2CO(g)+SO2(g)=S(s)+2CO2(g);
(4)某含有BaCO3沉淀的悬浊液中c(CO32)=0.2mol/L,根据碳酸钡溶度积计算溶液中c(Ba2+),如果加入等体积的Na2SO4溶液,计算混合后溶液中c(Ba2+),如溶液中生成BaSO4沉淀,则应在混合液中满足c(Ba2+)×c(SO42)>1×1010,计算混合溶液转化硫酸根最小浓度,原硫酸钠溶液最小浓度为混合后溶液中硫酸根离子最小浓度2倍;
(5)A.CH3COOH溶液、CH3COONa溶液氢氧根离子均源于水的电离;
B.根据电荷守恒:c(Na+)+c(H+)=c(CH3COO)+c(OH);
C.溶液呈中性,再根据电荷守恒c(Na+)+c(H+)=c(CH3COO)+c(OH)判断;
D.溶液呈碱性,此时溶液中钠离子浓度为0.05mol/L,结合电荷守恒c(Na+)+c(H+)=c(CH3COO)+c(OH)判断;
(6)①由图可知,A极CO发生氧化反应,CO失去电子与碳酸根离子结合生成二氧化碳;
②原电池中A为负极,B为正极,电解粗铜的精炼,粗铜作阳极,连接电源正极,精铜作阴极,连接电源负极。
(1)由题目信息可知,C与K2MnO4在硫酸条件下反应生成CO2、MnSO4、K2SO4与H2O,反应中K2MnO4中锰元素化合价降低4价,碳元素化合价升高4价,化合价升降最小公倍数为4,故K2MnO4前的系数是![]() ,故答案为:
,故答案为:![]() ;
;
(2)①实验2条件下平衡时生成氢气为0.4mol,由方程式可知消耗水为0.4mol,则平衡时水的物质的量为1mol0.4mol=0.6mol,反应前后气体物质的量不变,则平衡时混合气体总物质的量为3mol,故平衡时水的体积分数为![]() ×100%=20%,故答案为:20%;
×100%=20%,故答案为:20%;
②a.单位时间内生成n mol H2的同时生成n mol CO,生成的氢气与消耗氢气相等,反应到达平衡,故a正确;
b.反应前后气体物质的量不变,恒温恒容下,容器内压强始终不变化,故b错误;
c.混合气体总质量不变,容器容积不变,混合气体密度为定值,故c错误;
d.混合气体总质量不变,反应前后气体物质的量不变,混合气体的平均相对分子质量始终不变,故d错误;
e.随反应进行二氧化碳质量增大,其质量分数增大,CO2的质量分数不再变化说明到达平衡,故e正确;
故答案为:ae;
③已知:Ⅰ.C(s)+H2O(g)=CO(g)+H2(g),令平衡常数为K1,
Ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g),令平衡常数为K2,
则ⅡⅠ可得:CO(g)+H2O(g)CO2(g)+H2(g),故该反应平衡常数K=![]() ,故lgK=lgK2lgK1=0.03(0.39)=0.36,故答案为:0.36;
,故lgK=lgK2lgK1=0.03(0.39)=0.36,故答案为:0.36;
(3)已知:已知:①C(s)+O2(g)=CO2(g) △H1=393.5kJmol1
②CO2(g)+C(s)=2CO(g) △H2=+172.5kJmol1
③S(s)+O2(g)=SO2(g) △H3=296.0kJmol1
根据盖斯定律,①②③可得:2CO(g)+SO2(g)=S(s)+2CO2(g) △H=270kJmol1;
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g) △H=270kJmol1;
(4)某含有BaCO3沉淀的悬浊液中c(CO32)=0.2mol/L,溶液中c(Ba2+)=![]() mol/L=4×108mol/L,如果加入等体积的Na2SO4溶液,此时溶液中c(Ba2+)=2×108mol/L,如溶液中生成BaSO4沉淀,则应在混合液中满足c(Ba2+)×c(SO42)>1×1010,则c(SO42)>
mol/L=4×108mol/L,如果加入等体积的Na2SO4溶液,此时溶液中c(Ba2+)=2×108mol/L,如溶液中生成BaSO4沉淀,则应在混合液中满足c(Ba2+)×c(SO42)>1×1010,则c(SO42)>![]() mol/L=5×103mol/L,则加入Na2SO4溶液的物质的量浓度最小是2×5×103mol/L=0.01mol/L;故答案为:0.01;
mol/L=5×103mol/L,则加入Na2SO4溶液的物质的量浓度最小是2×5×103mol/L=0.01mol/L;故答案为:0.01;
(5)A.pH=3的CH3COOH溶液中氢氧根离子源于水电离,浓度为1010mol/L,为pH=11的CH3COONa溶液中,氢氧根离子也源于水的电离,溶液中氢氧根离子浓度为103mol/L,故错误;
B.①点时pH=6,此时溶液中c(H+)=106mol/L,c(OH)=108mol/L,由电荷守恒:c(Na+)+c(H+)=c(CH3COO)+c(OH),则c(CH3COO)c(Na+)=c(H+)c(OH)=106mol/L108mol/L=9.9×107mol/L,故B正确;
C.②点时溶液pH=7,则c(H+)=c(OH),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO)+c(OH),故溶液中的c(CH3COO)=c(Na+),故C正确;
D.③点时V=20mL,溶液呈碱性,则c(H+)<c(OH),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO)+c(OH),故溶液中的c(CH3COO)<c(Na+),此时c(Na+)=0.05mol/L,故D错误;
故答案为:BC;
(6)①由图可知,A极CO发生氧化反应,CO失去电子与碳酸根离子结合生成二氧化碳,电极反应式为:CO2e+CO32=2CO2;故答案为:CO2e+CO32=2CO2;
②原电池中A为负极,B为正极,电解粗铜的精炼,粗铜作阳极,连接电源正极,精铜作阴极,连接电源负极,故B极应该与D极相连;故答案为:D。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H1=a kJ/mol;
FeO(s)+CO(g) △H1=a kJ/mol;
②CO(g)+1/2O2(g) ![]() CO2(g) △H2=b kJ/mol
CO2(g) △H2=b kJ/mol
测得在不同温度下,反应①的平衡常数 K 值随温度的变化如下:
![]()
(1)若 500℃时进行反应①,CO2起始浓度为 2 mol·L-1,CO2的平衡浓度为____________。
(2)反应①中的 a_____________0(填“大于”“小于”或“等于”)。
(3)700℃反应已经①达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有_____________(填序号)
A.缩小反应器体积 B.通入 CO2
C.升高温度到 900℃ D.使用合适的催化剂
(4)下列图像符合反应①的是_____(填序号)(图中 v是速率、Φ为混合物中 CO2含量, T 为温度且 T1> T2)
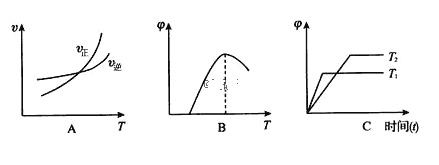
(5) 2Fe(s)+O2(g) ![]() 2FeO(s) △H3,该反应的△H3= ________kJ/mol。(用含 a、b的代数式表示)
2FeO(s) △H3,该反应的△H3= ________kJ/mol。(用含 a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,在0.1mol·L﹣1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:(填“正向”、“逆向”或“不移动”, “增大”、“减小”或“不变”, 填“>”、“<”或“=”)
(1)向醋酸中加入醋酸钠固体,电离平衡向___________移动;pH __________
(2)向醋酸中加入碳酸钙固体,电离平衡向________移动;c(CH3COOH)_________.
(3)向醋酸中加入大量的水,c(OH-)_________.导电能力__________.
(4)体积相同、物质的量浓度均为0.1 mol·L-1的①盐酸、②醋酸两种溶液,pH:①_____②;与完全相同的镁条发生反应,开始时的反应速率:①______ ②;中和等量NaOH时消耗的体积:①______②;与足量的Zn反应生成H2的物质的量:①_______②。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中不正确的是( )

A.W的含氧酸的酸性比Z的强
B.Y的价层电子排布式可能是ns2np4
C.X、Z、W的最高价氧化物所对应的水化物可能都是强酸
D.四种元素所形成的氢化物中,沸点最高的可能是Y的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
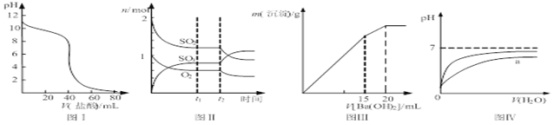
A. 图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂
B. 图Ⅱ表示一定条件下进行的反应2SO2+O2![]() 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
C. 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全
D. 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )

A.二茂铁分子中存在π键
B.lmol环戊二烯(![]() )中含有σ键的数目为11NA
)中含有σ键的数目为11NA
C.Fe2+的电子排布式为ls 22s 22p63s23p63d54s1
D.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示不正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
B.C(金刚石,s)=C(石墨,s) △H=-1.19kJ·mol-1,所以石墨比金刚石稳定
C.含1mol H2SO4的浓硫酸与足量的NaOH溶液反应,放出热量为57.3kJ
D.在101 kPa下,2 g H2 完全燃烧生成液态水放出285.8kJ热量,其热化学方程式为H2(g)+![]() O2
O2![]() H2O(l) △H=-285.8kJ·mol-1
H2O(l) △H=-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中进行反应:A(s)+2B(g)![]() C(g)+D(g),不能说明该反应已达到化学平衡的是
C(g)+D(g),不能说明该反应已达到化学平衡的是
A.B的体积分数不随时间变化而变化
B.压强不随时间变化而变化
C.混合气体的密度不再发生改变
D.单位时间内生成n mol A,同时生成n molC
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com