
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中不正确的是( )

A.W的含氧酸的酸性比Z的强
B.Y的价层电子排布式可能是ns2np4
C.X、Z、W的最高价氧化物所对应的水化物可能都是强酸
D.四种元素所形成的氢化物中,沸点最高的可能是Y的氢化物
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A.沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B.密度:CCl4>CHCl3>H2O>苯
C.含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D.同物质的量的物质燃烧耗O2量:己烷>环己烷>苯>苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图①可表示将SO2气体通入溴水时pH的变化
B. 图②表示KNO3的溶解度曲线,a点是80 ’C的KNO3的不饱和溶液
C. 图③表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 图④表示室温下,0.100 mol/L NaOH溶液分別滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是______________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___mol·L-1(填精确数值)。
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
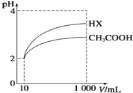
稀释后,HX溶液中水电离出来的c(H+)_____ (填“>”、“=”或“<”,下同)醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:图甲是由某温度下![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
图甲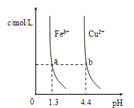 图乙
图乙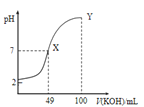
A.由图甲知:![]()
B.由图甲知:a、b点溶液中![]() ,b点的大
,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为![]() 的下列四种溶液:
的下列四种溶液:
①![]() 溶液 ②
溶液 ②![]() 溶液 ③
溶液 ③![]() 溶液 ④
溶液 ④![]() 溶液
溶液
(1)这四种溶液pH由大到小的顺序是______,其中由水电离的![]() 浓度最小的是______。(均填序号)
浓度最小的是______。(均填序号)
(2)②中各离子浓度由大到小的顺序是__________,![]() 的水解平衡常数
的水解平衡常数![]() ______
______![]() 。(已知碳酸的电离常数
。(已知碳酸的电离常数![]() )
)
(3)向③中通入少量氨气,此时 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中![]() 的含量及有效地开发利用
的含量及有效地开发利用![]() ,引起全世界的关注:
,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒![]() 杂质
杂质![]() ,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为
,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为![]() ,请写出对应的化学方程式并配平: ______ ;
,请写出对应的化学方程式并配平: ______ ;
(2)将不同量的![]() 和
和![]() 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应![]()
![]() ,得到如下两组数据:
,得到如下两组数据:
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所 需时间 | ||
| CO |
| CO | |||
1 | 650 | 2 | 4 |
|
| 5 |
2 | 900 | 1 | 2 |
|
| 3 |
①实验2条件下平衡时![]() 体积分数为 ______ ;
体积分数为 ______ ;
②下列方法中可以证明上述已达平衡状态的是 ______ ;
![]() 单位时间内生成nmol
单位时间内生成nmol![]() 的同时生成nmolCO
的同时生成nmolCO
![]() 容器内压强不再变化
容器内压强不再变化![]() 混合气体密度不再变化
混合气体密度不再变化
![]() 混合气体的平均相对分子质量不再变化
混合气体的平均相对分子质量不再变化![]() 的质量分数不再变化
的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值![]() 如下表,则反应
如下表,则反应![]() ,在900K时,该反应平衡常数的对数值
,在900K时,该反应平衡常数的对数值![]() ______ .
______ .
气化反应式 | lgK | ||
700K | 900K | 1200K | |
|
|
|
|
|
|
|
|
(3)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
![]()
![]()
![]()
![]()
![]()
![]()
请写出CO除![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
(4)![]() 时,
时,![]() 和
和![]() 的溶度积常数分别是
的溶度积常数分别是![]() 和
和![]() ,某含有
,某含有![]() 沉淀的悬浊液中
沉淀的悬浊液中![]() ,如果加入等体积的
,如果加入等体积的![]() 溶液,若要产生
溶液,若要产生![]() 沉淀,加入
沉淀,加入![]() 溶液的物质的量浓度最小是 ______
溶液的物质的量浓度最小是 ______ ![]() .
.
(5)![]() 时,在
时,在![]() 醋酸中加入V
醋酸中加入V![]() 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .
溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .

A.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液中,由水电离出的
溶液中,由水电离出的![]() 相等
相等
B.①点时![]() ,此时溶液中,
,此时溶液中,![]()
C.②点时,溶液中的![]()
D.③点时![]() ,此时溶液中
,此时溶液中![]()
(6)如图是一种新型燃料电池,它以CO为燃料,一定比例的![]() 和
和![]() 熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:
熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:

①写出A极发生的电极反应式 ______ ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与 ______ 极![]() 填“C”或“D”
填“C”或“D”![]() 相连.
相连.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)碳原子核外电子的空间运动状态有______种,基态锰原子的外围电子排布式为___,该原子能量最高的电子的电子云轮廓图形状为________。
(2)N、C和Mn电负性由大到小的顺序为____________。
(3)HSCH2CH2NH2中C的杂化方式为_____,其中NH2-空间构型为____;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是_______。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。
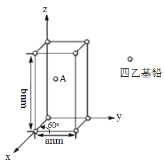
Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是___,A分子的坐标参数为_____;设阿伏加德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____g/cm3 (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇属于可再生能源,可作汽车的燃料,下列能正确表示甲醇燃烧热的热化学方程式为
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=+763.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=+763.3 kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-763.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-763.3 kJ·mol-1
C.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 526.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com