
【题目】常温下,有浓度均为![]() 的下列四种溶液:
的下列四种溶液:
①![]() 溶液 ②
溶液 ②![]() 溶液 ③
溶液 ③![]() 溶液 ④
溶液 ④![]() 溶液
溶液
(1)这四种溶液pH由大到小的顺序是______,其中由水电离的![]() 浓度最小的是______。(均填序号)
浓度最小的是______。(均填序号)
(2)②中各离子浓度由大到小的顺序是__________,![]() 的水解平衡常数
的水解平衡常数![]() ______
______![]() 。(已知碳酸的电离常数
。(已知碳酸的电离常数![]() )
)
(3)向③中通入少量氨气,此时 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
【答案】④②③① ① ![]()
![]() 减小 大于
减小 大于
【解析】
1)酸和碱溶液抑制了水的电离,盐溶液促进了水的电离,酸或者碱溶液中氢离子、氢氧根离子浓度越大,水的电离程度越小,据此进行解答;
(2)碳酸氢钠溶液呈碱性,说明碳酸氢根的水解程度大于电离程度,结合水的电离写出酸氢钠溶液中离子浓度大小顺序;根据![]() 进行计算;
进行计算;
(3)通过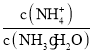 与平衡常数之间的关系判断;
与平衡常数之间的关系判断;
(4)先比较等体积混合后溶液的酸碱性,然后判断溶液显示中性时二者体积关系;
(1)④是强碱,溶液中![]() ,①是二元强酸,溶液中
,①是二元强酸,溶液中![]() ,二者均抑制水的电离,①抑制程度大。故答案为:④②③⑤①;①;
,二者均抑制水的电离,①抑制程度大。故答案为:④②③⑤①;①;
(2)依据![]() 、
、![]()
![]()
![]() (程度大)、
(程度大)、![]()
![]()
![]() (程度小)、
(程度小)、![]()
![]()
![]() 可知溶液中各离子浓度大小;
可知溶液中各离子浓度大小;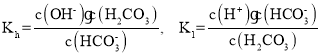 可知
可知![]() 。故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);2.5×10-8;
。故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);2.5×10-8;
(3) 一水合氨的电离平衡常数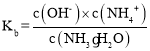 ,所以
,所以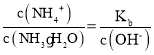 ,通入氨气后,溶液中氢氧根离子浓度增大,该比值减小,故答案为:减小
,通入氨气后,溶液中氢氧根离子浓度增大,该比值减小,故答案为:减小
(4)如果等体积混合,恰好完全反应生成![]() ,溶液显碱性,所以
,溶液显碱性,所以![]() 过量。故答案为:大于;
过量。故答案为:大于;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2。A的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图。关于A的下列说法中,不正确的是( )

A.A属于芳香化合物
B.A的结构简式为![]()
C.A属于羧酸类化合物
D.在红外光谱图中可以获得分子中含有的化学键或官能团的信息
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.若NaA、NaB溶液的pH分别为9和8,则酸性一定是HA<HB
B.FeCl3溶液蒸干得FeCl3固体,Na2CO3溶液蒸干得Na2CO3固体
C.中和pH和体积均相同的盐酸和醋酸溶液,后者消耗NaOH的物质的量多
D.因Fe2++2H2O![]() Fe(OH)2+2H+,为抑制水解,配制Fe(NO3)2溶液时需将Fe(NO3)2溶解在稀HNO3中
Fe(OH)2+2H+,为抑制水解,配制Fe(NO3)2溶液时需将Fe(NO3)2溶解在稀HNO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有![]() ,请按要求填空:
,请按要求填空:
(1)在水溶液中,水解后溶液呈碱性的离子是___________________________________________________________________________。
(2)在水溶液中,水解后溶液呈酸性的离子是_____________________________________________________________________________。
(3)既能在酸性较强的溶液中大量存在,又能在碱性较强的溶液中大量存在的离子有__________________________________________________________。
(4)既不能在酸性较强的溶液中大量存在,又不能在碱性较强的溶液中大量存在的离子有_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中不正确的是( )

A.W的含氧酸的酸性比Z的强
B.Y的价层电子排布式可能是ns2np4
C.X、Z、W的最高价氧化物所对应的水化物可能都是强酸
D.四种元素所形成的氢化物中,沸点最高的可能是Y的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:

已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。

(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。

①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )

A.二茂铁分子中存在π键
B.lmol环戊二烯(![]() )中含有σ键的数目为11NA
)中含有σ键的数目为11NA
C.Fe2+的电子排布式为ls 22s 22p63s23p63d54s1
D.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
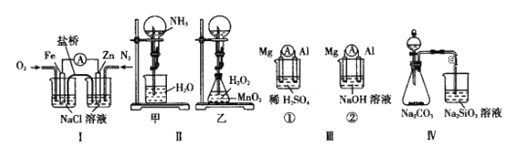
A.图I装置中通入N2和O2的作用是相同的
B.图II中甲、乙两装置产生喷泉的原理一样
C.图III①装置中镁片是原电池的负极,②装置镁片是原电池的正极
D.图IV分液漏斗中盛硝酸能证明非金属性:N>C>Si,盛硫酸能证明非金属性:S>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法正确的是
①糖类、蛋白质、油脂属于天然高分子化合物
②煤经气化和液化两个物理变化过程,可变为清洁能源
③制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
④用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
⑤苯、油脂均不能使酸性![]() 溶液褪色
溶液褪色
⑥葡萄糖、果糖的分子式均为![]() ,二者互为同分异构体
,二者互为同分异构体
⑦甲烷和![]() 的反应与乙烯和
的反应与乙烯和![]() 的反应属于同一类型的反应
的反应属于同一类型的反应
⑧乙醇、乙酸均能与Na反应放出![]() ,二者分子中官能团相同
,二者分子中官能团相同
⑨中和滴定实验时,用待测液润洗锥形瓶
⑩非金属元素组成的化合物中只含共价键
A.1B.2C.3D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com