
【题目】大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)碳原子核外电子的空间运动状态有______种,基态锰原子的外围电子排布式为___,该原子能量最高的电子的电子云轮廓图形状为________。
(2)N、C和Mn电负性由大到小的顺序为____________。
(3)HSCH2CH2NH2中C的杂化方式为_____,其中NH2-空间构型为____;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是_______。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。
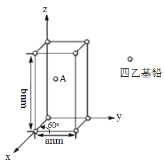
Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是___,A分子的坐标参数为_____;设阿伏加德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____g/cm3 (列出计算式即可)。
【答案】6 3d54s2 球形 N>C>Mn sp3 V型 N原子半径较小,不能容纳较多的原子轨道,故不能形成H3NO4 分子 6 ![]()
![]()
【解析】
(1)原子核外电子运动状态和该原子的核外电子数相等,原子序数为27的锰元素基态原子的外围电子排布式为3d54s2,据此可以得出锰元素在周期表中的位置是第四周期第ⅤⅡB族,能量最高的电子是4s2电子,4s电子的电子云轮廓图为球形;
(2)电负性是金属性与非金属性定量描述的一个物理量,元素的非金属性越强,往往其电负性越大,根据元素周期表中元素非金属性(或电负性)的递变规律,同周期从左到右元素电负性增大;
(3)HSCH2CH2NH2分子中,C形成4个共价键,它们价层电子对数为4对,其杂化方式为sp3,在-NH2中N有两个单键,一对孤对电子和一个单电子,因为单电子也需要占用一个轨道,所以N的价层电子对数依然可以视为4对,其杂化方式也为sp3,考虑配位原子只有两个H,所以其空间构型为平面三角形,N和P为同族元素,其价层电子数相同,通常情况下其成键方式相同,但是由于N原子半径小于P,N原子周围空间无法容纳4个氧原子成键;
(4)题目信息,Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,可知其晶体类型为分子晶体,这一点也可以从Pb(CH2CH3)4晶体的堆积方式得到结论,Pb(CH2CH3)4晶体堆积方式为六方密堆积,所以在xy平面上的二维堆积中也采取二维最密堆积即配位数为6,由堆积图可知每个晶胞中包含2个Pb(CH2CH3)4分子,所以每一个晶胞的质量为![]() g,再结合晶胞参数,长方体的棱边长度,计算得到晶胞的体积为
g,再结合晶胞参数,长方体的棱边长度,计算得到晶胞的体积为![]() cm3,则Pb(CH2CH3)4晶体的密度=
cm3,则Pb(CH2CH3)4晶体的密度=![]() 。
。
(1)碳原子核外电子排布为1s22s22p2,核外电子的空间运动状态有6种,原子序数为27的锰元素基态原子的外围电子排布式为3d54s2,据此可以得出锰元素在周期表中的位置是第四周期第ⅤⅡB族,能量最高的电子是4s2电子,值得注意的是,教材上提供的构造原理是原子填充顺序规则,并不代表电子的能量高低,在金属元素的原子中,最易失去的电子才是该原子能量最高的电子,4s电子的电子云轮廓图为球形,故答案为:6;3d54s2;球形;
(2)电负性是金属性与非金属性定量描述的一个物理量,元素的非金属性越强,往往其电负性越大,根据元素周期表中元素非金属性(或电负性)的递变规律,同周期从左到右元素电负性增大,可以得到电负性大小为N大于C,而Mn为金属元素,其电负性小于非金属性,N、C和Mn三种元素的电负性由大到小的顺序为:N、C、Mn,故答案为:N、C、Mn;
(3)HSCH2CH2NH2分子中,C形成4个共价键,它们价层电子对数为4对,其杂化方式为sp3,在-NH2中N有两个单键,一对孤对电子和一个单电子,因为单电子也需要占用一个轨道,所以N的价层电子对数依然可以视为4对,其杂化方式也为sp3,考虑配位原子只有两个H,所以其空间构型为平面三角形,N和P为同族元素,其价层电子数相同,通常情况下其成键方式相同,但是由于N原子半径小于P,N原子周围空间无法容纳4个氧原子成键,所以在其最高价含氧酸中,前者为一元酸后者为三元酸,或说H3NO4分子会因为N原子半径小,无法容纳4个氧原子成键,要脱去一个水分子,以HNO3形式存在,故答案为:sp3;平面三角形;N和P为同族元素,其价层电子数相同,通常情况下其成键方式相同,但是由于N原子半径小于P,N原子周围空间无法容纳4个氧原子成键,所以在其最高价含氧酸中,前者为一元酸后者为三元酸,或说H3NO4分子会因为N原子半径小,无法容纳4个氧原子成键,要脱去一个水分子,以HNO3形式存在;
(4)题目信息,Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,可知其晶体类型为分子晶体,这一点也可以从Pb(CH2CH3)4晶体的堆积方式得到结论,Pb(CH2CH3)4晶体堆积方式为六方密堆积,所以在xy平面上的二维堆积中也采取二维最密堆积即配位数为6,A分子的坐标参数为(![]() )由堆积图可知每个晶胞中包含2个Pb(CH2CH3)4分子,所以每一个晶胞的质量为
)由堆积图可知每个晶胞中包含2个Pb(CH2CH3)4分子,所以每一个晶胞的质量为![]() g,再结合晶胞参数,可以得到晶胞的体积为
g,再结合晶胞参数,可以得到晶胞的体积为![]() cm3,则Pb(CH2CH3)4晶体的密度是
cm3,则Pb(CH2CH3)4晶体的密度是![]() g·cm-3,故答案为:分子;6;
g·cm-3,故答案为:分子;6;![]() 。
。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:

回答下列问题:
(1)A的结构简式为____。
(2)D中含有的官能团是____,分子中最多有___个碳原子共平面。
(3)①的反应类型是___,④的反应类型是____。
(4)⑤的化学方程式为___。
(5)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:____。
的合成路线:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中不正确的是( )

A.W的含氧酸的酸性比Z的强
B.Y的价层电子排布式可能是ns2np4
C.X、Z、W的最高价氧化物所对应的水化物可能都是强酸
D.四种元素所形成的氢化物中,沸点最高的可能是Y的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )

A.二茂铁分子中存在π键
B.lmol环戊二烯(![]() )中含有σ键的数目为11NA
)中含有σ键的数目为11NA
C.Fe2+的电子排布式为ls 22s 22p63s23p63d54s1
D.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示不正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
B.C(金刚石,s)=C(石墨,s) △H=-1.19kJ·mol-1,所以石墨比金刚石稳定
C.含1mol H2SO4的浓硫酸与足量的NaOH溶液反应,放出热量为57.3kJ
D.在101 kPa下,2 g H2 完全燃烧生成液态水放出285.8kJ热量,其热化学方程式为H2(g)+![]() O2
O2![]() H2O(l) △H=-285.8kJ·mol-1
H2O(l) △H=-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
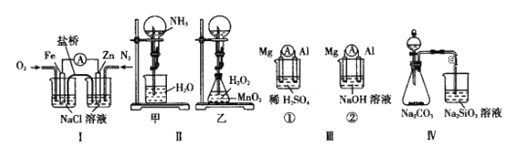
A.图I装置中通入N2和O2的作用是相同的
B.图II中甲、乙两装置产生喷泉的原理一样
C.图III①装置中镁片是原电池的负极,②装置镁片是原电池的正极
D.图IV分液漏斗中盛硝酸能证明非金属性:N>C>Si,盛硫酸能证明非金属性:S>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学。
(1)普通玻璃是常见的硅酸盐产品,其主要成分的化学式为Na2CaSi6O14,以氧化物形式可表示为______。
(2)缺铁性贫血患者补充的铁,通常为硫酸亚铁的形式,而硫酸铁则没有这种药效.当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是______.若在酸性的硫酸亚铁溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式______.检验棕黄色溶液是否有Fe2+,可选用的试剂为______(填字母)。
A.稀硝酸B.浓硫酸C.KSCN溶液D.酸性高锰酸钾溶液
(3)从降低成本和减少环境污染的角度考虑,制取硫酸铜最好的方法是______(填字母)。
A.铜和浓硫酸反应B.铜和稀硫酸反应
C.氧化铜和硫酸反应D.铜与Fe2(SO4)3溶液反应
(4)实验室用硫酸铜晶体配制一定物质的量浓度的硫酸铜溶液,下列操作将使所配溶液物质的量浓度偏高的是______(填字母)。
A.所用的硫酸铜晶体已经部分风化失水
B.移液时不小心溅出少许溶液
C.容量瓶查漏后未经干燥就直接使用
D.定容时俯视容量瓶刻度线
E.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为VL的密闭容器中加入1 molX和1 molY进行如下反应: X(g)+Y(g)![]() 2Z(g)+W(s) △H>0达到平衡,下列判断正确的是
2Z(g)+W(s) △H>0达到平衡,下列判断正确的是
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后加入催化剂,上述反应的△H增大
C.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的![]()
D.升高温度,平衡逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com