
【题目】一定温度下,在体积为VL的密闭容器中加入1 molX和1 molY进行如下反应: X(g)+Y(g)![]() 2Z(g)+W(s) △H>0达到平衡,下列判断正确的是
2Z(g)+W(s) △H>0达到平衡,下列判断正确的是
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后加入催化剂,上述反应的△H增大
C.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的![]()
D.升高温度,平衡逆向移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)碳原子核外电子的空间运动状态有______种,基态锰原子的外围电子排布式为___,该原子能量最高的电子的电子云轮廓图形状为________。
(2)N、C和Mn电负性由大到小的顺序为____________。
(3)HSCH2CH2NH2中C的杂化方式为_____,其中NH2-空间构型为____;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是_______。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。
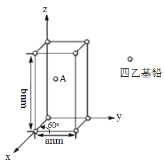
Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是___,A分子的坐标参数为_____;设阿伏加德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____g/cm3 (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇属于可再生能源,可作汽车的燃料,下列能正确表示甲醇燃烧热的热化学方程式为
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=+763.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=+763.3 kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-763.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-763.3 kJ·mol-1
C.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 526.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置的叙述中正确的是( )

A.用此装置给铁镀铜,镀件应放在b电极
B.用此装置给铁镀铜,反应一段时间后溶液中铜离子浓度基本不变
C.用此装置电解精炼铜,反应一段时间后溶液中铜离子浓度基本不变
D.用此装置电解精炼铜,粗铜应放在a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
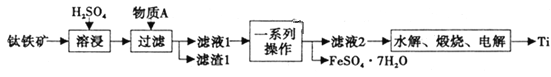
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为________。
(2)物质A为________(填化学式),“一系列操作”为________。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________、________。(写出两条)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为________;若制得金属Ti 9.60g,阳极产生气体________mL(标准状况下)。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式________;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A. 2:1:1
B. 1:1:2
C. 1:2:1
D. 4:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:

(1)Cr2O72-中元素铬(Cr)的化合价为_____。
(2)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入![]() 溶液直至过量,可观察到的现象是____。
溶液直至过量,可观察到的现象是____。
(3)CrO42-和Cr2O72-在溶液中可相互转化:2CrO42-+2H+![]() Cr2O72-+H2O,室温下,初始浓度为1.0molL-1的Na2CrO4溶液中,c(Cr2O72-)随c(H+)的变化如图所示。
Cr2O72-+H2O,室温下,初始浓度为1.0molL-1的Na2CrO4溶液中,c(Cr2O72-)随c(H+)的变化如图所示。
①溶液酸性增大,CrO42-的平衡转化率_________。(填“增大”“减小”或“不变”)。
②根据A点数据,计算出该转化反应的平衡常数为___________。
③温度升高,溶液中CrO42-的平衡转化率减小,则该反应的ΔH____0(填“>、=、<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秸秆(含多糖物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是___。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为___。
(3)D中官能团名称为____,D生成E的反应类型为___。
(4)F的化学名称是___,由F生成G的化学方程式为___。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5molW与足量碳酸氢钠溶液反应生成44gCO2,W共有___种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为____。
(6)参照上述合成路线,以(反,反)-2,4-己二烯和C2H4为原料(无机试剂任选),设计制备对苯二甲酸的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
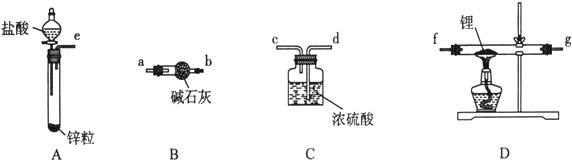
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置按气流从左到右连接顺序为________________,加入药品前首先要进行的实验操作是____________(不必写出具体的操作方法);其中装置B的作用是___________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是____________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,通氢气的作用是___________________________;在加热D处的石英管之前,必须进行的实验操作是__________。
(4)加热一段时间后,停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险,反应方程式为_____________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com