
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是______________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___mol·L-1(填精确数值)。
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
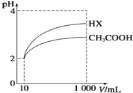
稀释后,HX溶液中水电离出来的c(H+)_____ (填“>”、“=”或“<”,下同)醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
【答案】增大a>b>d>ccd9.9×10-7 moL·L-1>>
【解析】
升高温度促进弱电解质的电离;酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱;酸性强弱为CH3COOH>H2CO3>HClO>HCO3-,强酸能够制取弱酸;根据混合液中的电荷守恒计算;加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大;加水稀释HX溶液中氢离子浓度减小,对水的抑制程度减小。
(1)升高温度促进弱电解质的电离,所以当温度升高时,Ka增大。(2)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c。(3)a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;b.ClO-+CH3COOH═CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;c.CO32-+HClO═CO2↑+H2O+ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;故选cd。d.2ClO-+CO2+H2O═CO32-+2HClO:由于酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=(10-6-10-8)mol·L-1=9.9×10-7mol·L-1。(5)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+);溶液中氢离子浓度越小,对的抑制程度越小,水的电离程度越大,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱。


科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:

回答下列问题:
(1)A的结构简式为____。
(2)D中含有的官能团是____,分子中最多有___个碳原子共平面。
(3)①的反应类型是___,④的反应类型是____。
(4)⑤的化学方程式为___。
(5)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:____。
的合成路线:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.若NaA、NaB溶液的pH分别为9和8,则酸性一定是HA<HB
B.FeCl3溶液蒸干得FeCl3固体,Na2CO3溶液蒸干得Na2CO3固体
C.中和pH和体积均相同的盐酸和醋酸溶液,后者消耗NaOH的物质的量多
D.因Fe2++2H2O![]() Fe(OH)2+2H+,为抑制水解,配制Fe(NO3)2溶液时需将Fe(NO3)2溶解在稀HNO3中
Fe(OH)2+2H+,为抑制水解,配制Fe(NO3)2溶液时需将Fe(NO3)2溶解在稀HNO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,在0.1mol·L﹣1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:(填“正向”、“逆向”或“不移动”, “增大”、“减小”或“不变”, 填“>”、“<”或“=”)
(1)向醋酸中加入醋酸钠固体,电离平衡向___________移动;pH __________
(2)向醋酸中加入碳酸钙固体,电离平衡向________移动;c(CH3COOH)_________.
(3)向醋酸中加入大量的水,c(OH-)_________.导电能力__________.
(4)体积相同、物质的量浓度均为0.1 mol·L-1的①盐酸、②醋酸两种溶液,pH:①_____②;与完全相同的镁条发生反应,开始时的反应速率:①______ ②;中和等量NaOH时消耗的体积:①______②;与足量的Zn反应生成H2的物质的量:①_______②。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有![]() ,请按要求填空:
,请按要求填空:
(1)在水溶液中,水解后溶液呈碱性的离子是___________________________________________________________________________。
(2)在水溶液中,水解后溶液呈酸性的离子是_____________________________________________________________________________。
(3)既能在酸性较强的溶液中大量存在,又能在碱性较强的溶液中大量存在的离子有__________________________________________________________。
(4)既不能在酸性较强的溶液中大量存在,又不能在碱性较强的溶液中大量存在的离子有_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中不正确的是( )

A.W的含氧酸的酸性比Z的强
B.Y的价层电子排布式可能是ns2np4
C.X、Z、W的最高价氧化物所对应的水化物可能都是强酸
D.四种元素所形成的氢化物中,沸点最高的可能是Y的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )

A.二茂铁分子中存在π键
B.lmol环戊二烯(![]() )中含有σ键的数目为11NA
)中含有σ键的数目为11NA
C.Fe2+的电子排布式为ls 22s 22p63s23p63d54s1
D.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学。
(1)普通玻璃是常见的硅酸盐产品,其主要成分的化学式为Na2CaSi6O14,以氧化物形式可表示为______。
(2)缺铁性贫血患者补充的铁,通常为硫酸亚铁的形式,而硫酸铁则没有这种药效.当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是______.若在酸性的硫酸亚铁溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式______.检验棕黄色溶液是否有Fe2+,可选用的试剂为______(填字母)。
A.稀硝酸B.浓硫酸C.KSCN溶液D.酸性高锰酸钾溶液
(3)从降低成本和减少环境污染的角度考虑,制取硫酸铜最好的方法是______(填字母)。
A.铜和浓硫酸反应B.铜和稀硫酸反应
C.氧化铜和硫酸反应D.铜与Fe2(SO4)3溶液反应
(4)实验室用硫酸铜晶体配制一定物质的量浓度的硫酸铜溶液,下列操作将使所配溶液物质的量浓度偏高的是______(填字母)。
A.所用的硫酸铜晶体已经部分风化失水
B.移液时不小心溅出少许溶液
C.容量瓶查漏后未经干燥就直接使用
D.定容时俯视容量瓶刻度线
E.未洗涤烧杯和玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com