
25℃时,水的离子积为1.0×10-14;100℃时,水的离子积为1.0×10-12.若在100℃时,将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,请填空:
(1)100℃比25℃时水的离子积较大的原因是:________.
(2)若混合后所得溶液为中性,则a∶b=________;若所得混合溶液的pH=2,则a∶b=________.
科目:高中化学 来源:101网校同步练习 高二化学 山东科学技术出版社 鲁教版 题型:021
|
下列说法中,正确的是 | |
A. |
向纯水中加入少量盐酸,Kw将增大 |
B. |
25℃时,水的离子积常数Kw=1.0×10-7 mol2·L-2 |
C. |
100℃时,纯水的[H+]=10-7 mol·L-1呈中性 |
D. |
100℃时,pH=7的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源:同步题 题型:不定项选择题
 H++OH-,在25℃时,水的离子积:KW=1×10-14,在35℃时,水的离子积:
H++OH-,在25℃时,水的离子积:KW=1×10-14,在35℃时,水的离子积:查看答案和解析>>
科目:高中化学 来源:同步题 题型:不定项选择题
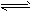 H++OH-,在25℃时,水的离子积:Kw=1×10-14,在35℃时,水的离子积:
H++OH-,在25℃时,水的离子积:Kw=1×10-14,在35℃时,水的离子积:查看答案和解析>>
科目:高中化学 来源: 题型:
根据25℃时,水的离子积常数KW=1×10-14,100℃时,KW=10-12,这说明
A.水的电离过程是一个吸热的过程
B.100℃时,水的电离常数(K)较大
C.KW和K无直接关系
D.25℃时的c(H+)比100℃时的c(H+)大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com