
| A. | Zn是正极,Ag2O是负极 | |
| B. | 使用过程中,电子由Ag2O极经外路流向Zn极 | |
| C. | 使用过程中,电极负极区溶液的pH减小 | |
| D. | Zn电极发生氧化反应,Ag2O电极发生还原反应 |
分析 A.电池反应中Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极、Ag2O是正极;
B.该原电池中,Zn是负极、Ag2O是正极,电子从负极沿导线流向正极;
C.根据元素化合价变化知,Zn失电子而作负极,负极上OH-参加反应导致其浓度减小;
D.失电子的物质发生氧化反应、得电子的物质发生还原反应.
解答 解:A.电池反应中Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极、Ag2O是正极,故A错误;
B.该原电池中,Zn是负极、Ag2O是正极,电子从负极Zn沿导线流向正极Ag2O,故B错误;
C.根据元素化合价变化知,Zn失电子而作负极,负极上OH-参加反应导致其浓度减小,溶液的碱性降低,pH减小,故C正确;
D.Zn失电子发生氧化反应、Ag2O得电子发生还原反应,故D错误;
故选C.
点评 本题考查化学电源新型电池,侧重考查分析判断能力,明确元素化合价变化与电极关系是解本题关键,知道各个电极上反应类型、电子及电流流向,题目难度不大.


科目:高中化学 来源: 题型:解答题
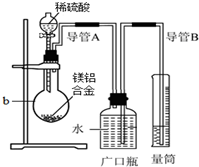 化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.
化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol/(L•s) | B. | 0.08 mol/(L•s) | C. | 0.16 mol/(L•s) | D. | 0.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
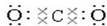 ,O=C=O.
,O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(CH3COO-)>c (Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.02mol/L | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COO-)+c(H+)=c (Na+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
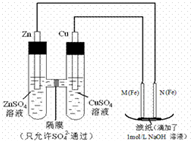 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 坐标对应点 | a | b | c | d |
| n(SO32-):n(HSO32-) | / | 91:9 | 1:1 | 9:91 |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com