
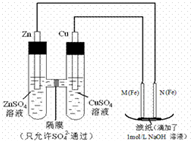
 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.分析 图中,左边装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,如果要找电极材料代替铜,所找材料必须是不如锌活泼的金属或导电的非金属,M是阳极,N是阴极,电解池中阴极上阳离子得电子发生还原反应,原电池放电时,阴离子向负极移动,据此分析.
解答 解:(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,
故答案为:A;
(2)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-),
故答案为:2H2O+2e-═H2↑+2OH-;
(3)原电池放电时,阴离子向负极移动,所以硫酸根从右向左移动,电解池中,阴极上氢离子得电子生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,所以滤纸上有红褐色斑点产生,
故答案为:从右向左; 滤纸上有红褐色斑点产生.
点评 本题考查了原电池和电解池原理,侧重于学生的分析能力的考查,注意电解池中如果活泼金属作阳极,则电解池工作时阳极材料失电子发生氧化反应,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用大量SO2漂白银耳 | |
| B. | 用小苏打(NaHCO3)焙制糕点 | |
| C. | 硅胶常用作食品、药品干燥剂 | |
| D. | 用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn是正极,Ag2O是负极 | |
| B. | 使用过程中,电子由Ag2O极经外路流向Zn极 | |
| C. | 使用过程中,电极负极区溶液的pH减小 | |
| D. | Zn电极发生氧化反应,Ag2O电极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可用石墨做阳极,铁做阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-=ClO-+H2O | |
| C. | 若铁做阴极,则电解过程中溶液中的阳离子向铁电极运动 | |
| D. | 除去CN-的反应,2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属的冶炼方法有4种,其中铝热反应属于热分解法 | |
| B. | 海带中碘元素的检验原理:2H++2I-+H2O2=I2+2H2O | |
| C. | 石油的分馏,裂化,裂解,催化重整中裂化是物理变化 | |
| D. | 铝热反应中铝做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
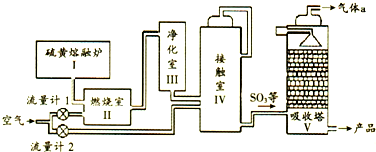
| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)?SO3(g)△H=-297kJ•mol-1S(s)+O2(s)=SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2(s) $?_{△}^{催化剂}$SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2中既含有离子键又含有共价键 | |
| B. | Na0H中既含有离子键又含有共价键 | |
| C. | Na2O2中只含有离子键 | |
| D. | 由非金属元素组成的物质NH4Cl中只有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
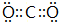 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com